- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Амины (органические производные аммиака)
Содержание
- 2. Амины (органические производные аммиака)
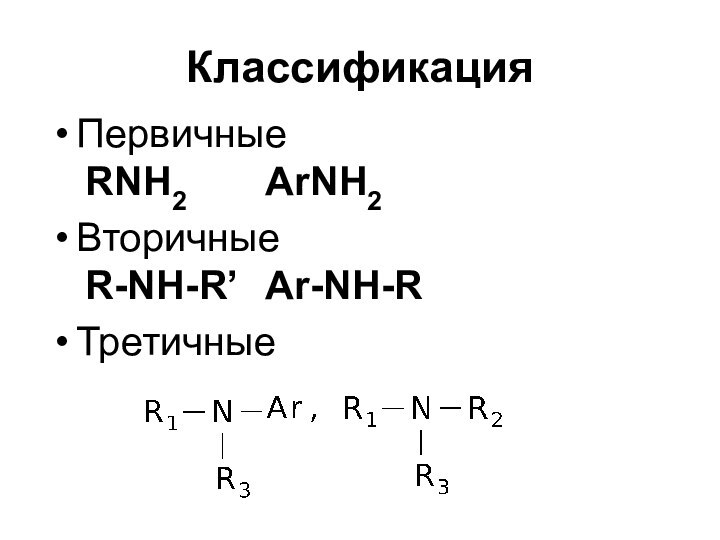
- 3. КлассификацияПервичные RNH2 ArNH2 Вторичные R-NH-R’ Ar-NH-R Третичные
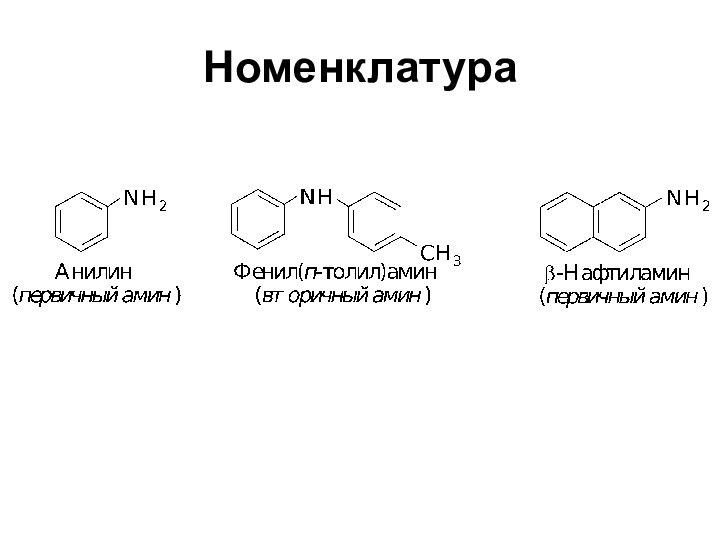
- 4. Номенклатура
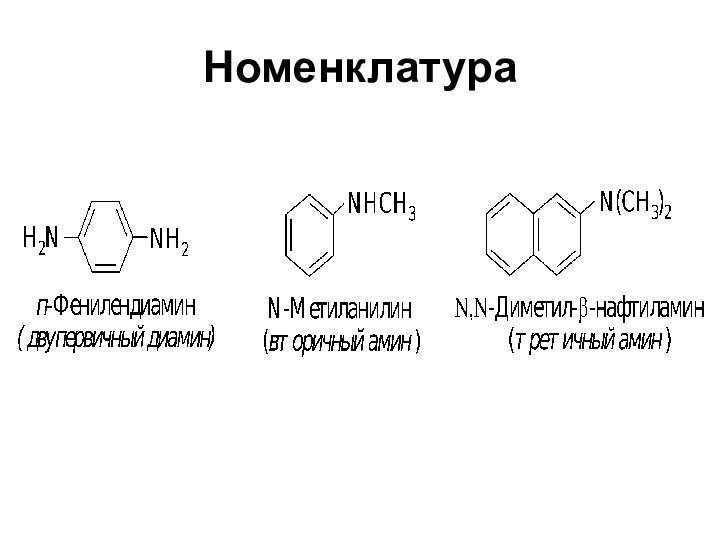
- 5. Номенклатура
- 6. Получение
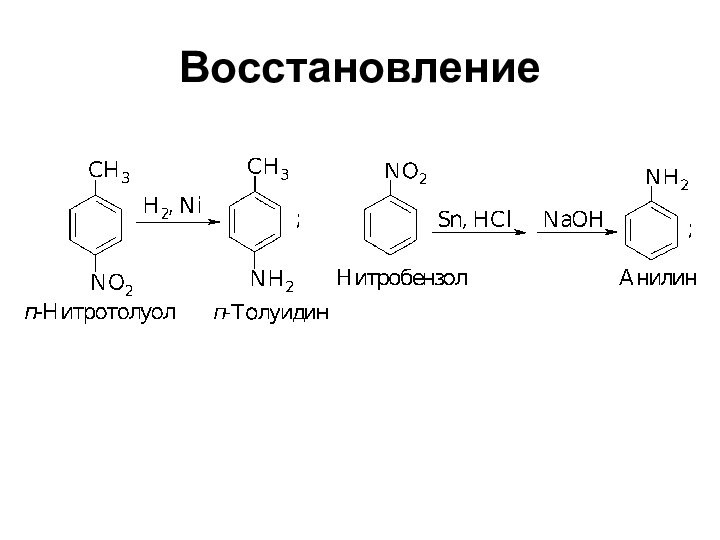
- 7. Восстановление
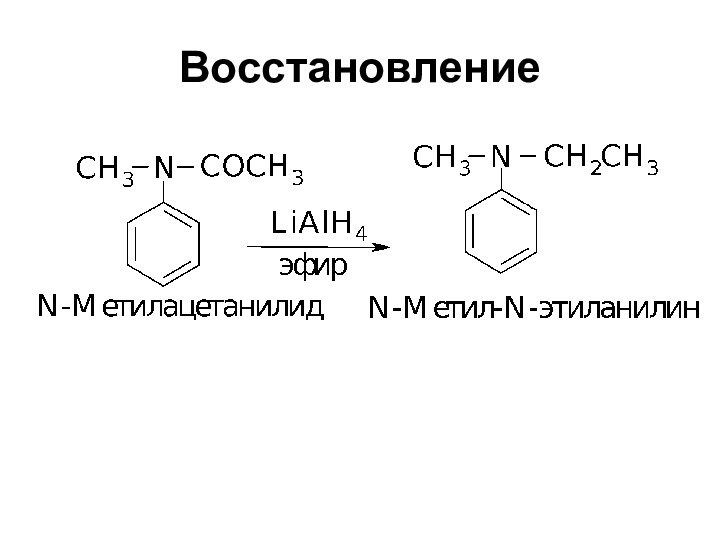
- 8. Восстановление
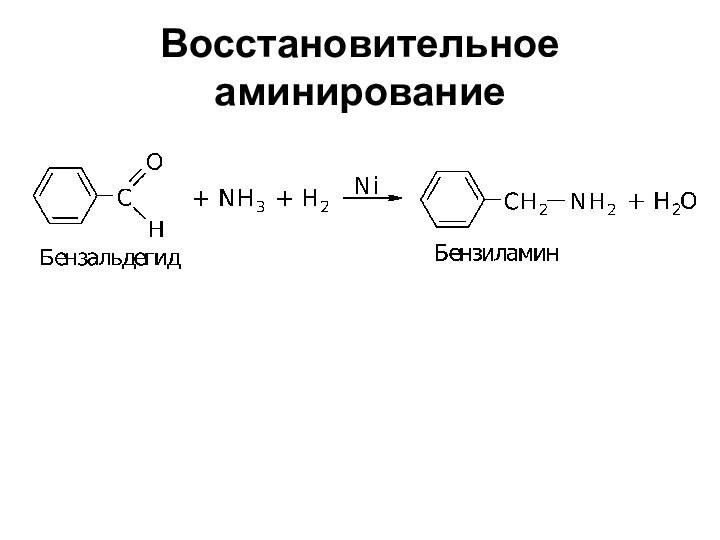
- 9. Восстановительное аминирование
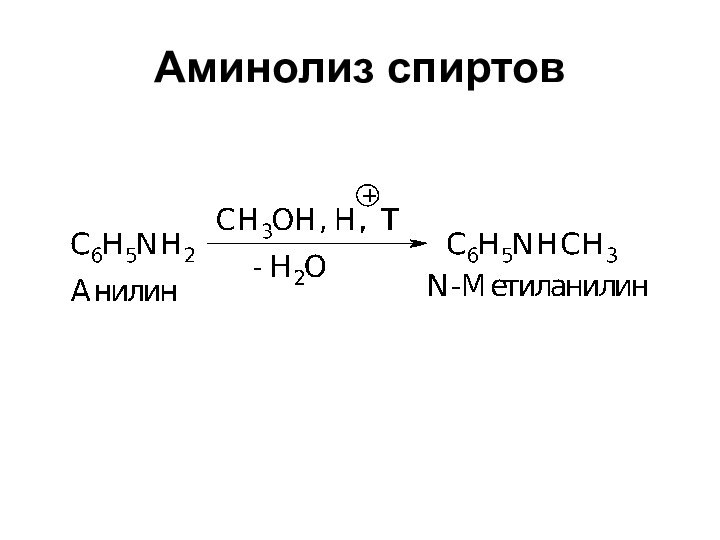
- 10. Аминолиз спиртов
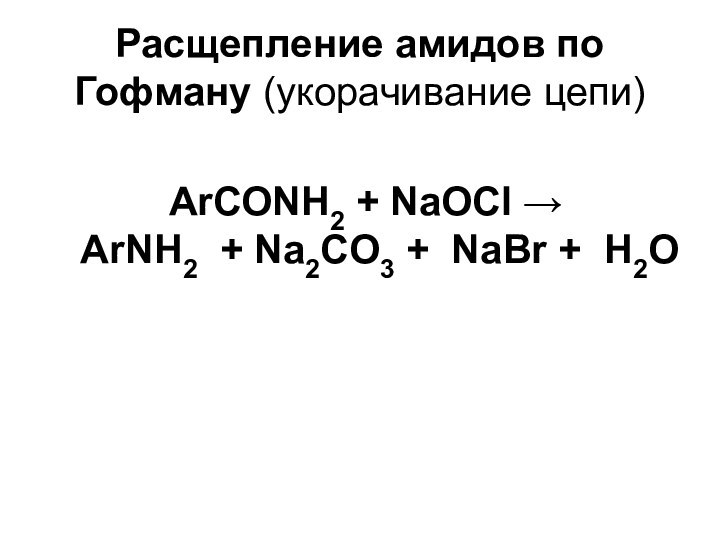
- 11. Расщепление амидов по Гофману (укорачивание цепи)ArСОNH2 +
- 12. Физические свойстваАроматические амины – жидкости или твердые
- 13. Химические свойстваАмины являются основаниямиАмины способны выступать в качестве нуклеофильных реагентов
- 14. Основность аминов ArNH2 + H2O ArNH3+
- 15. Основность В + Н2О НВ+ +
- 16. Основность аминов Ароматические амины менее основны чем алифатические
- 17. Резонансный или мезомерный эффект
- 18. Основность (pKBH+) NH3 9.21 CH3NH2 10.62 C2H5NH2 10.63(CH3)2NH 10.71 (C2H5)2NH 10.98(CH3)3N 9.76 (C2H5)3N 10.65PhNH2 4.58PhNHCH3 4.85 PhN(CH3)2 5.06
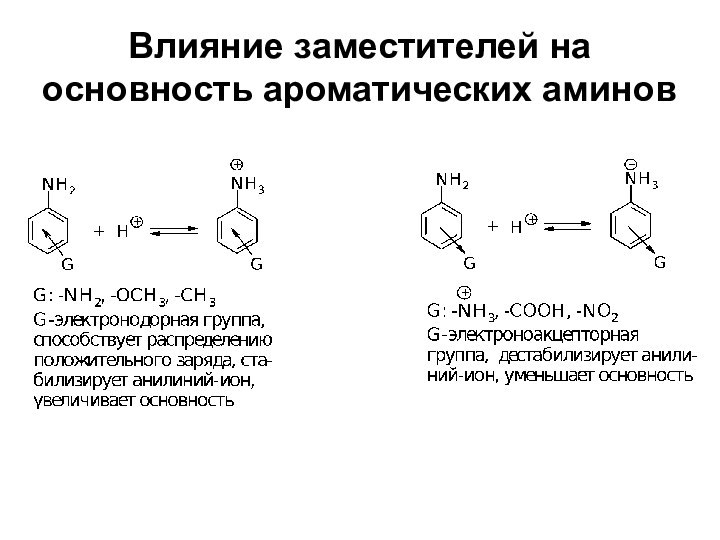
- 19. Влияние заместителей на основность ароматических аминов
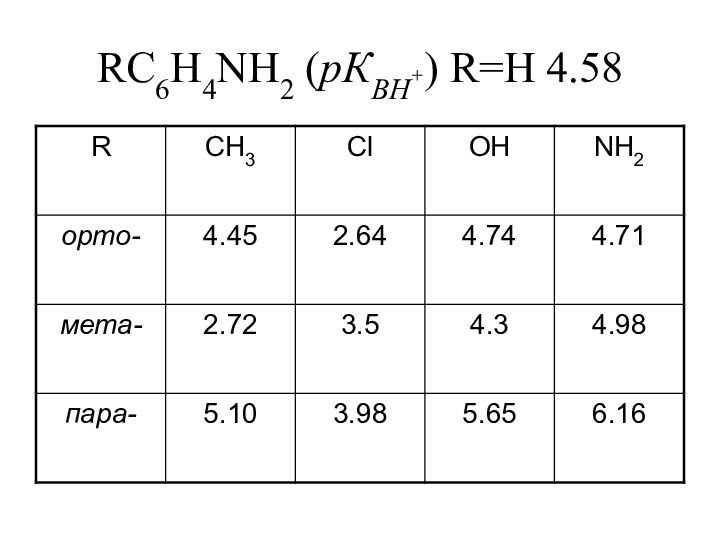
- 20. RC6H4NH2 (pКBH+) R=H 4.58
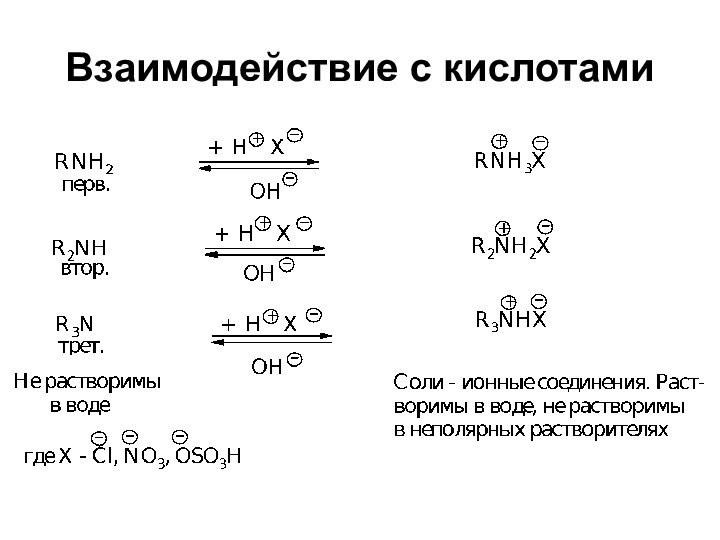
- 21. Взаимодействие с кислотами
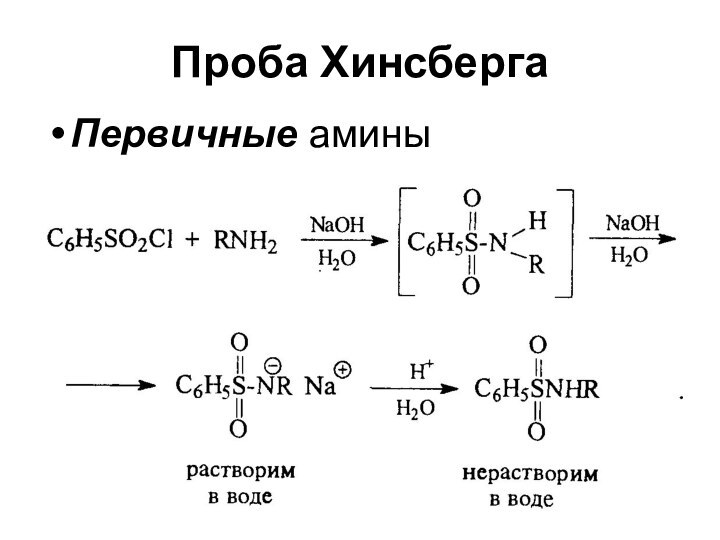
- 22. Проба ХинсбергаПервичные амины
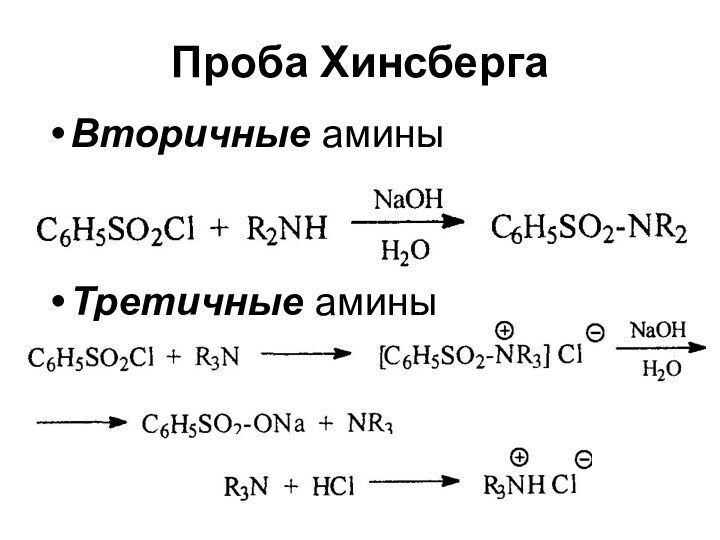
- 23. Проба ХинсбергаВторичные аминыТретичные амины
- 24. Ароматические амины Первичные при взаимодействии с азотистой
- 25. Ароматические амины Вторичные при взаимодействии с азотистой кислотой образуют N-нитрозосоединения
- 26. Ароматические аминыТретичные при взаимодействии с азотистой кислотой образуют ароматические нитрозосоединения
- 27. Ароматические амины
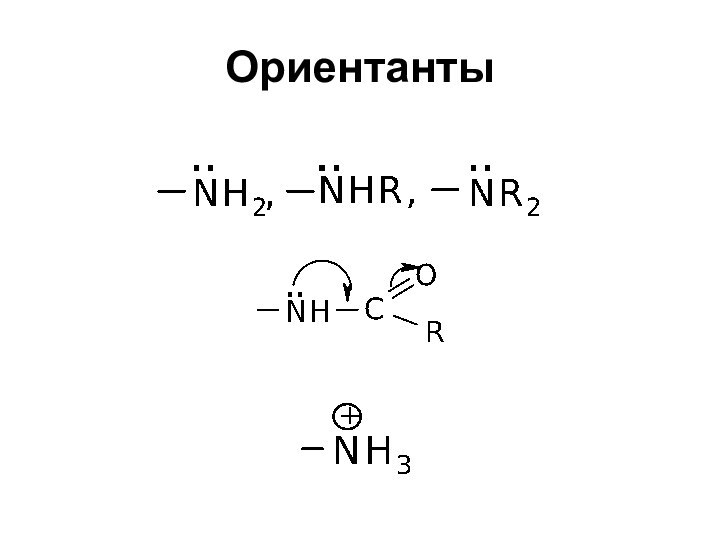
- 29. Замещение в кольце ароматических аминов
- 30. Ориентанты
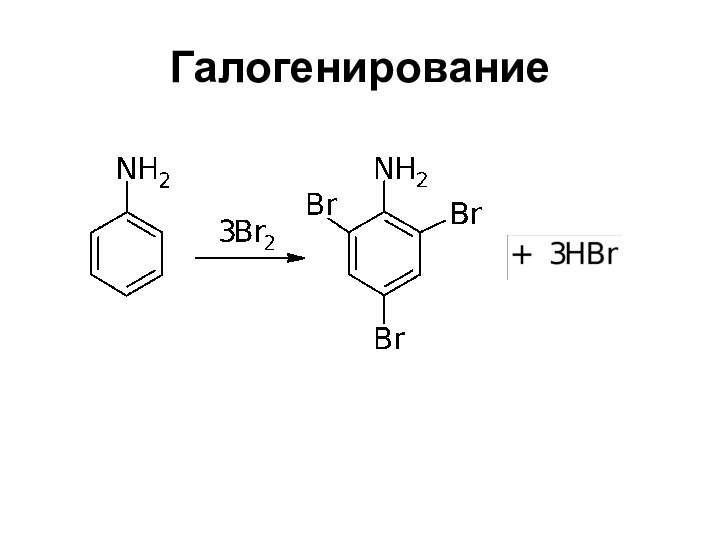
- 31. Галогенирование
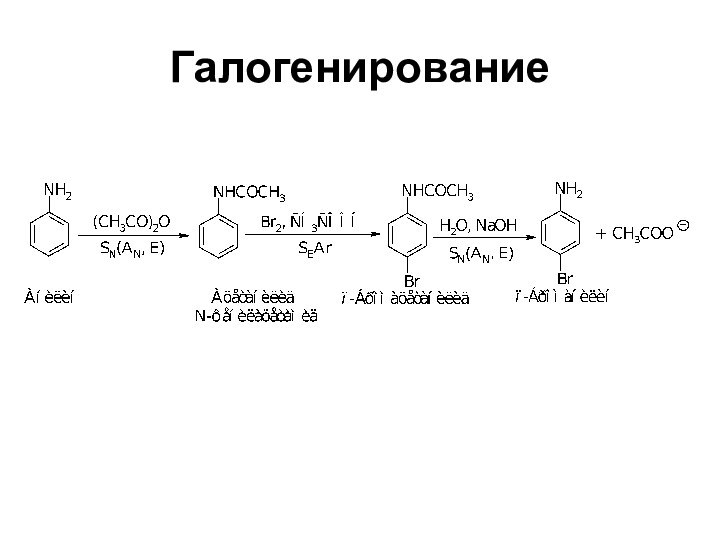
- 32. Галогенирование
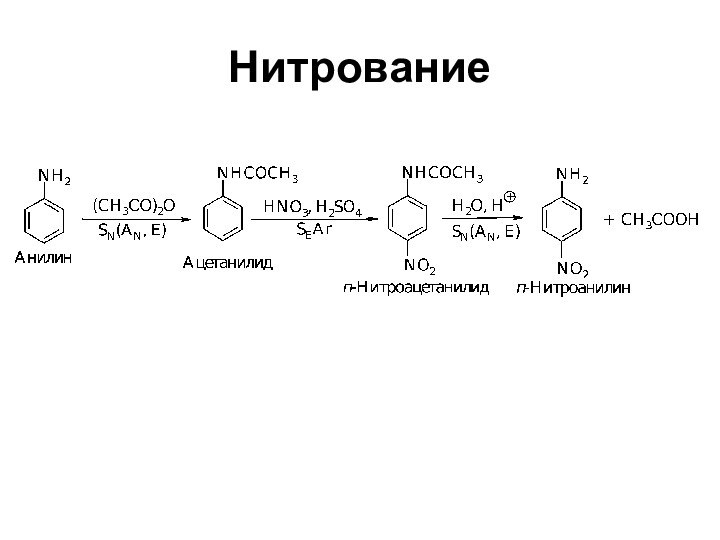
- 33. Нитрование
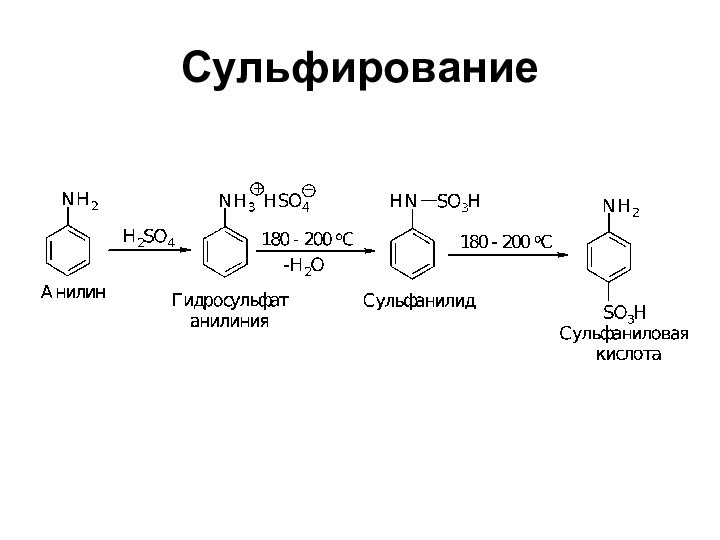
- 34. Сульфирование
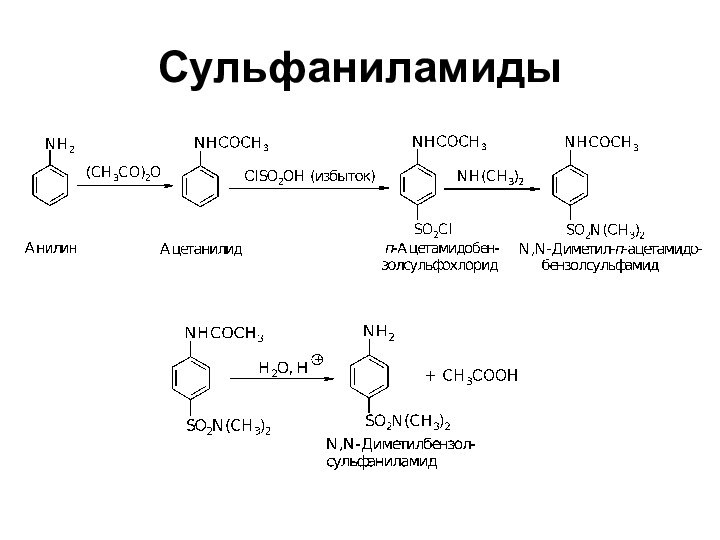
- 35. Сульфаниламиды
- 36. Диазосоединения Соли диазония
- 37. ДиазосоединенияВ которых группа –N2– связана с углеводородным
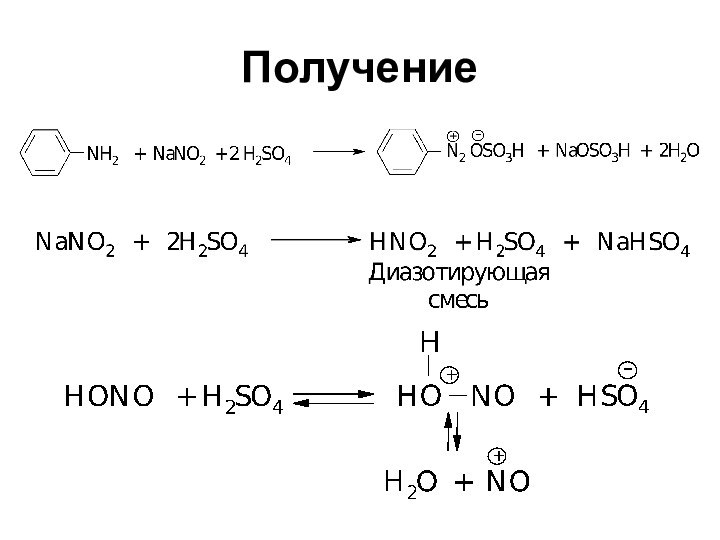
- 38. Получение
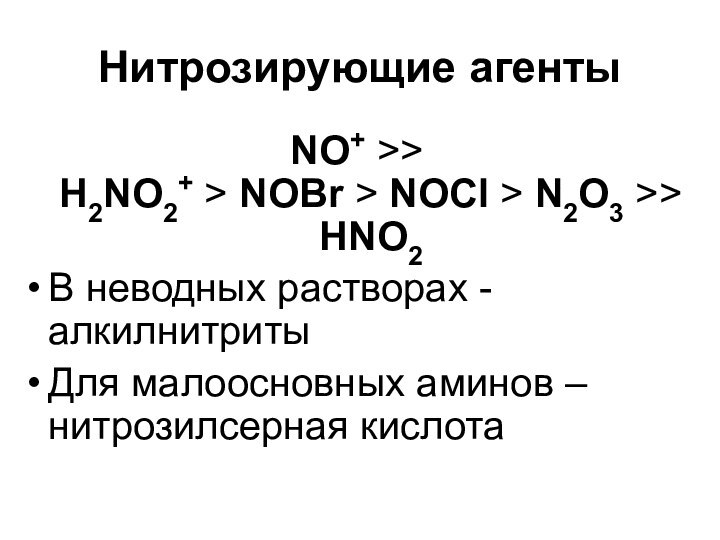
- 39. Нитрозирующие агентыNO+ >> H2NO2+ > NOBr
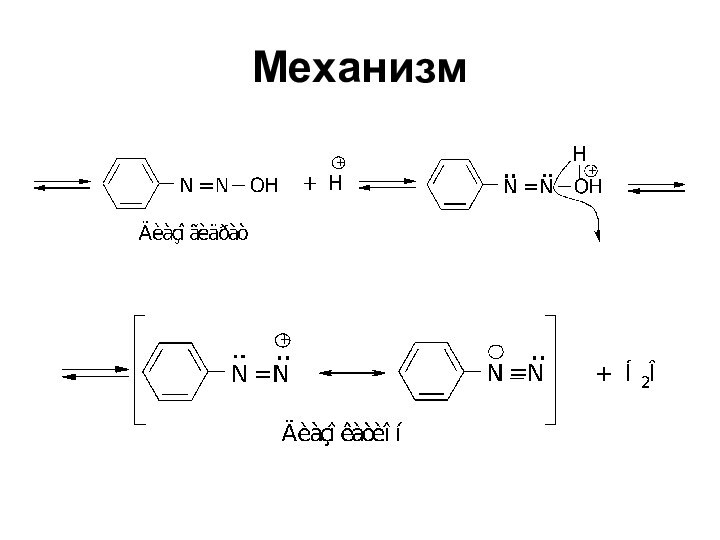
- 40. Механизм
- 41. Механизм
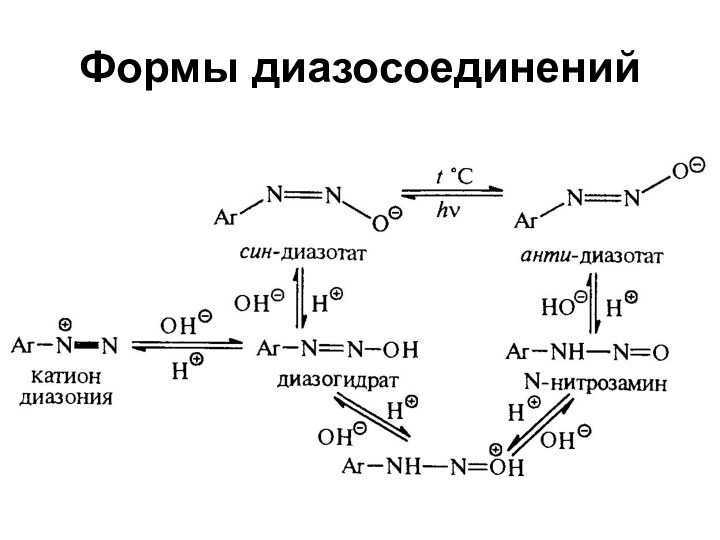
- 42. Формы диазосоединений
- 43. Свойства солей диазония
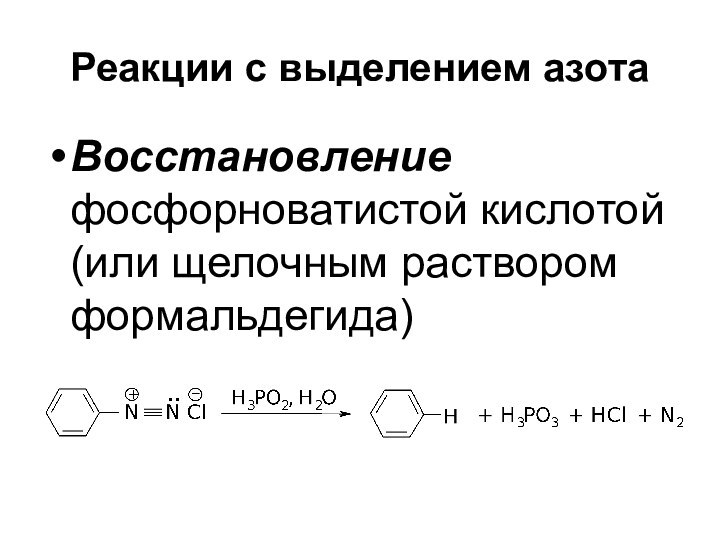
- 44. Реакции с выделением азота Восстановление фосфорноватистой кислотой (или щелочным раствором формальдегида)
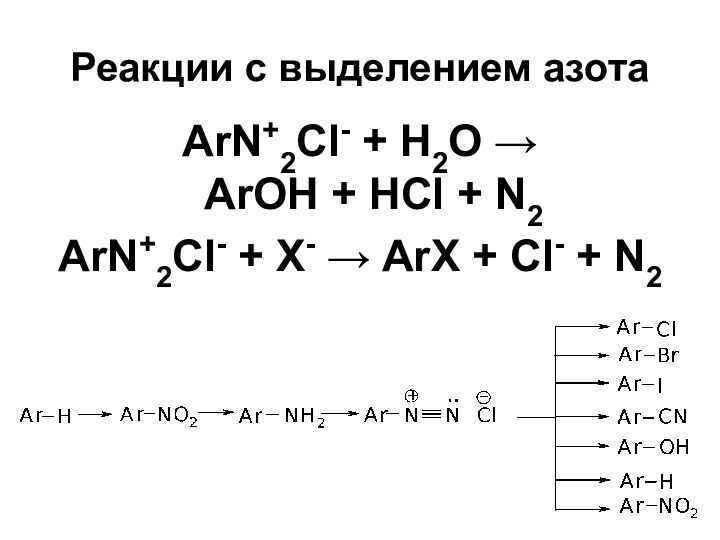
- 45. Реакции с выделением азота ArN+2Cl- + Н2О
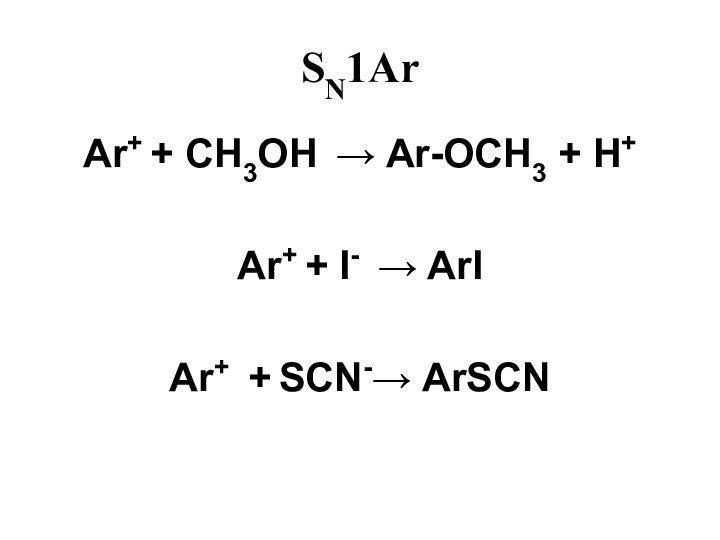
- 46. SN1Ar ArN2+ N2 +
- 47. SN1Ar Ar+ + CH3OH Ar-OCH3 + H+Ar+ + I- ArIAr+ + SCN- ArSCN
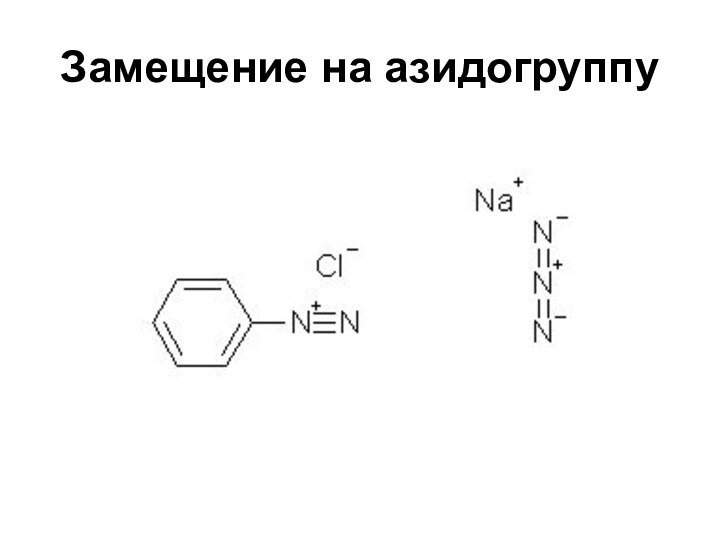
- 48. Замещение на азидогруппу
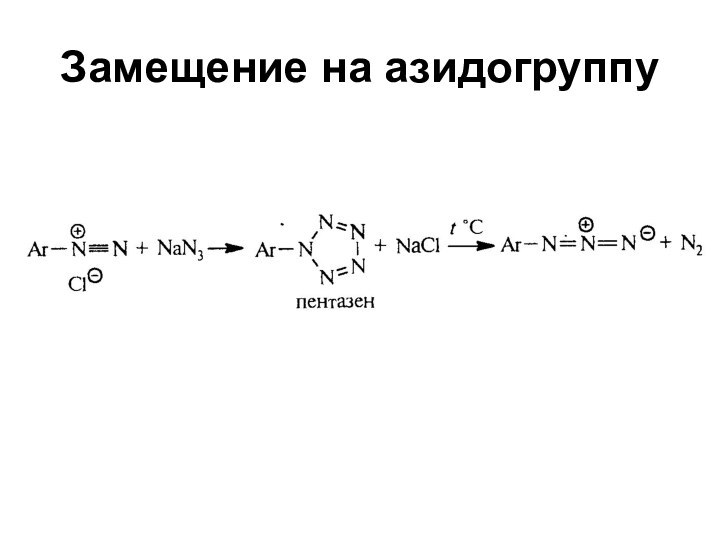
- 49. Замещение на азидогруппу
- 50. SN1Ar1) Скорость не зависит от [Nu]2) Влияние
- 51. Катализ (SRN)
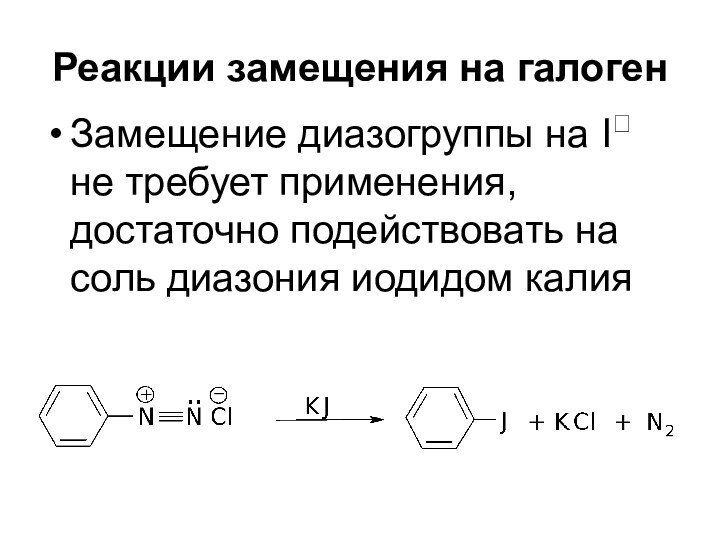
- 52. Реакции замещения на галоген Реакции с использованием
- 53. Реакции замещения на галоген
- 54. Реакции замещения на галогенЗамещение диазогруппы на I
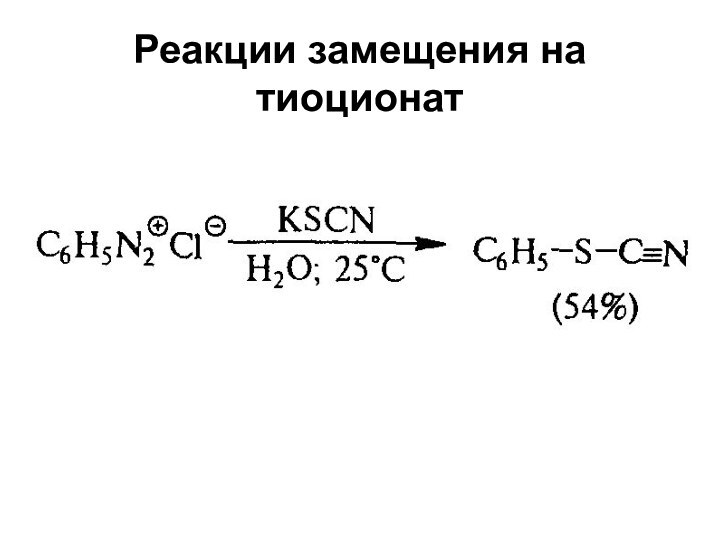
- 55. Реакции замещения на тиоционат
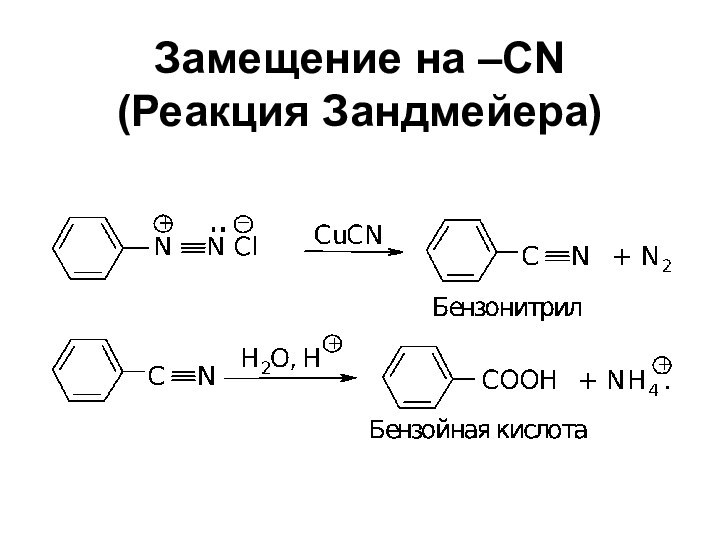
- 56. Замещение на –CN (Реакция Зандмейера)
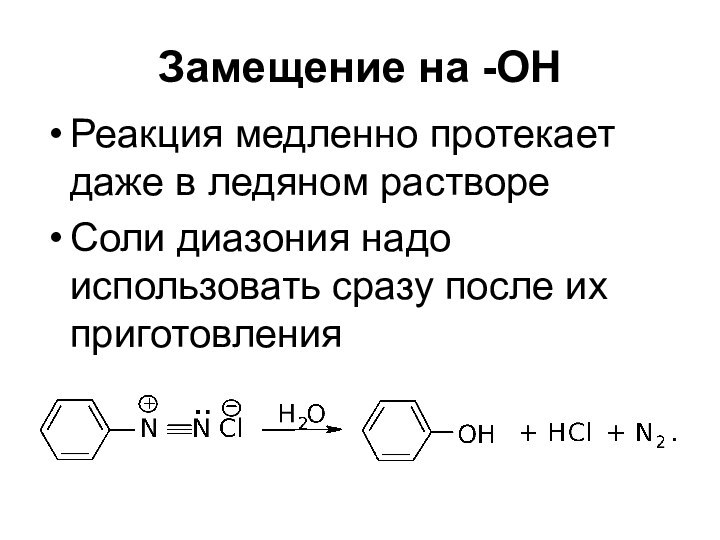
- 57. Замещение на -ОНРеакция медленно протекает даже в
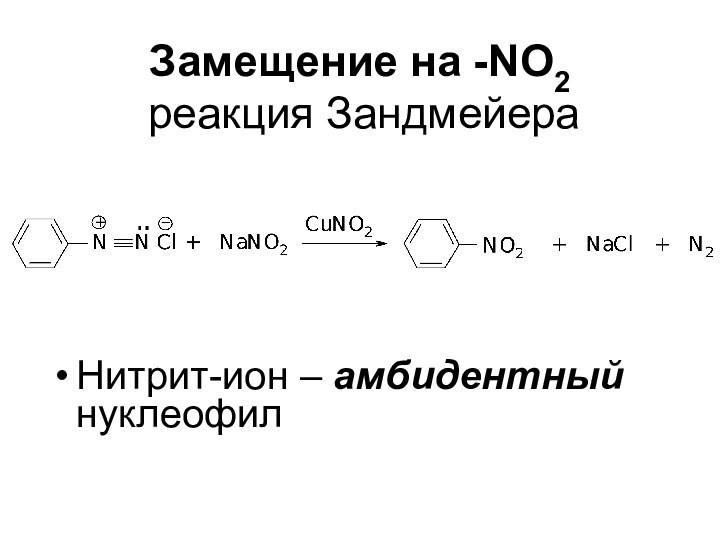
- 58. Замещение на -NО2 реакция ЗандмейераНитрит-ион – амбидентный нуклеофил
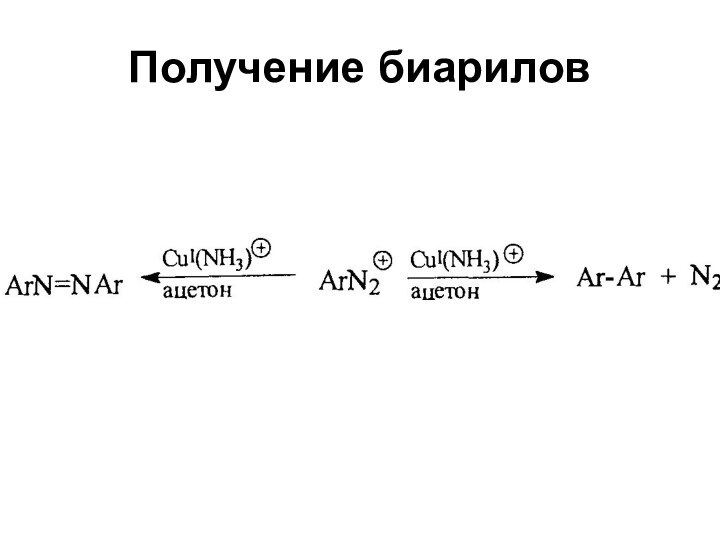
- 59. Получение биарилов
- 60. Реакции солей диазония без выделения азота
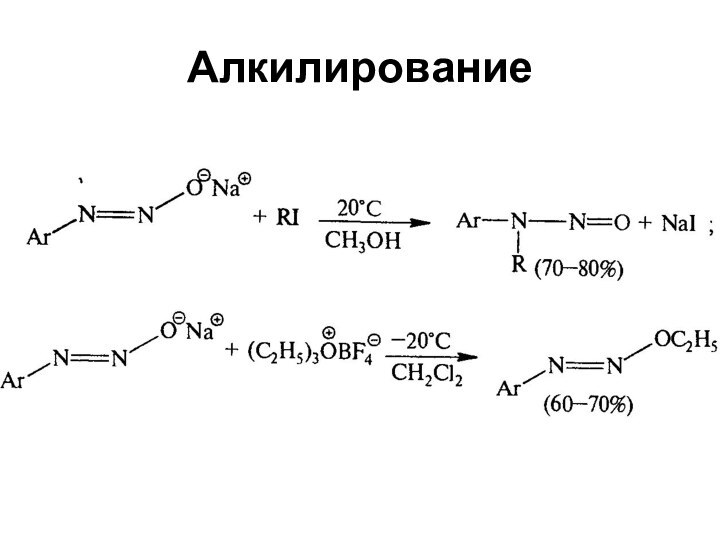
- 61. Алкилирование
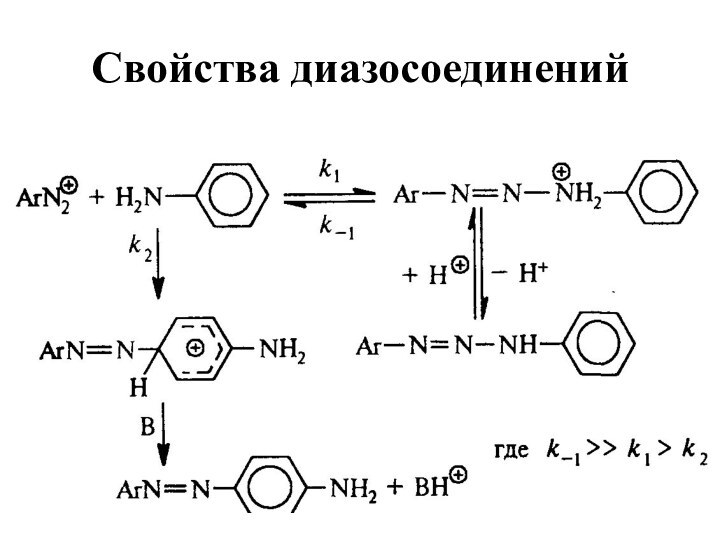
- 62. Свойства диазосоединенийArN2+ + [Н] ArNHNH2
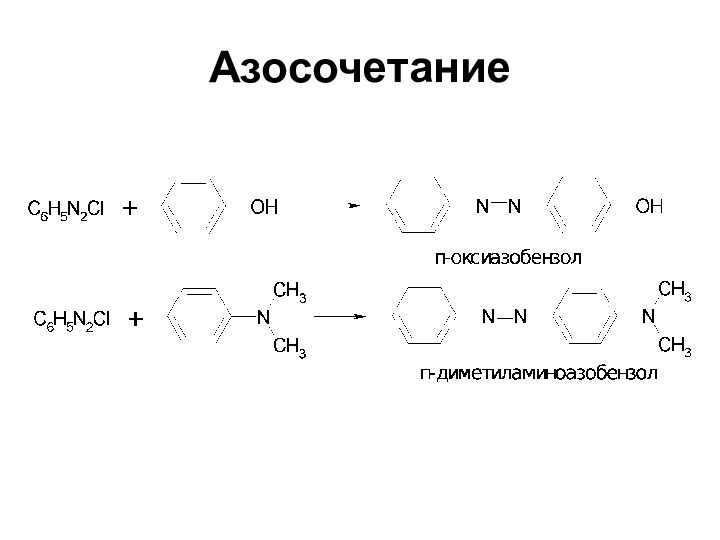
- 63. Азосочетание Соли диазония в определенных условиях реагируют
- 64. АзосочетаниеЗамещение обычно протекает в п-положение, если оно занято, сочетание происходит в о-положение
- 65. Азосочетание
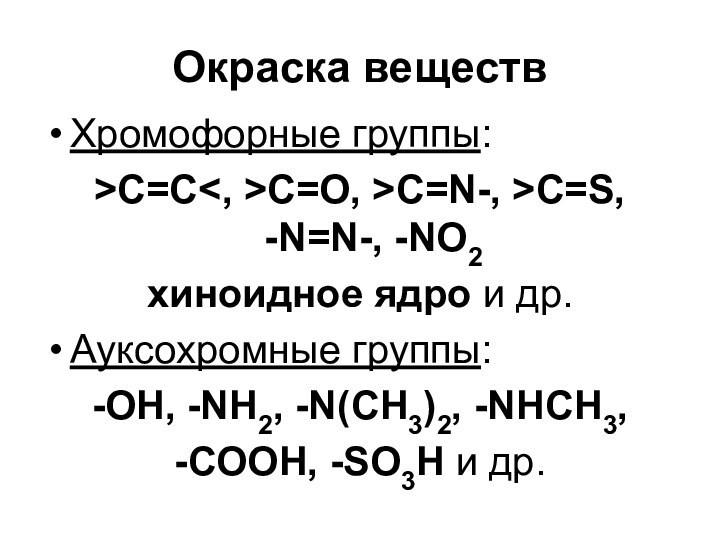
- 66. Окраска веществХромофорные группы:>C=CC=O, >C=N-, >C=S, -N=N-,
- 67. Механизм реакции Электрофильное замещение SEArЭлектрофильный агент - ион диазония, очень слабый электрофил
- 68. Механизм реакции-комплекс
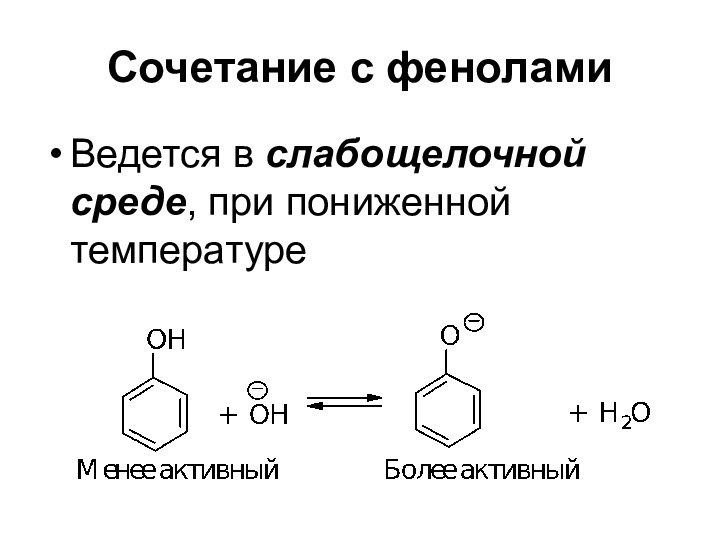
- 69. Сочетание с фенолами Ведется в слабощелочной среде, при пониженной температуре
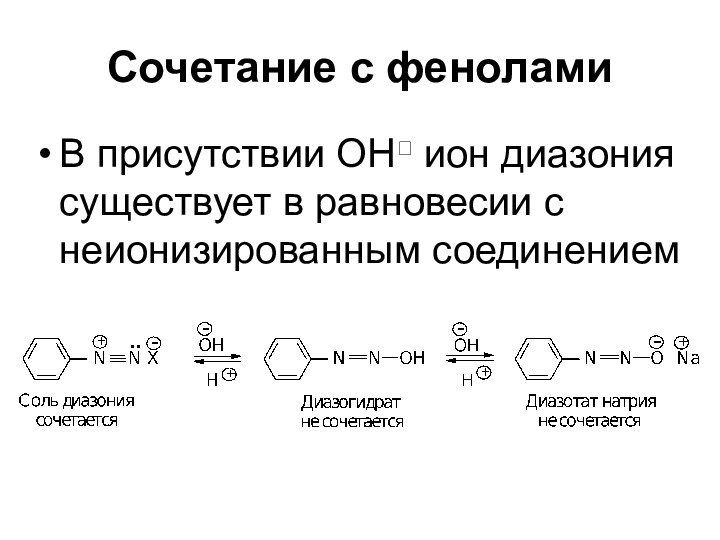
- 70. Сочетание с феноламиВ присутствии ОН ион диазония существует в равновесии с неионизированным соединением
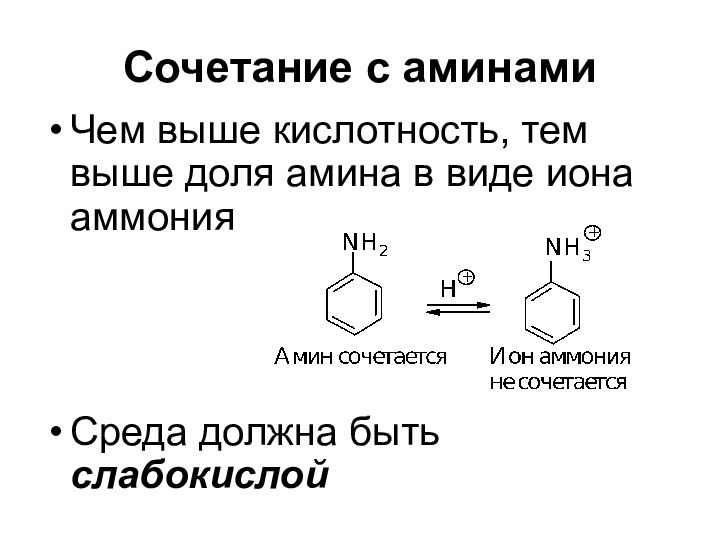
- 71. Сочетание с аминами Высокая кислотность среды способствует тому, что диазосоединение полностью находится в виде диазокатиона
- 72. Сочетание с аминами Чем выше кислотность, тем
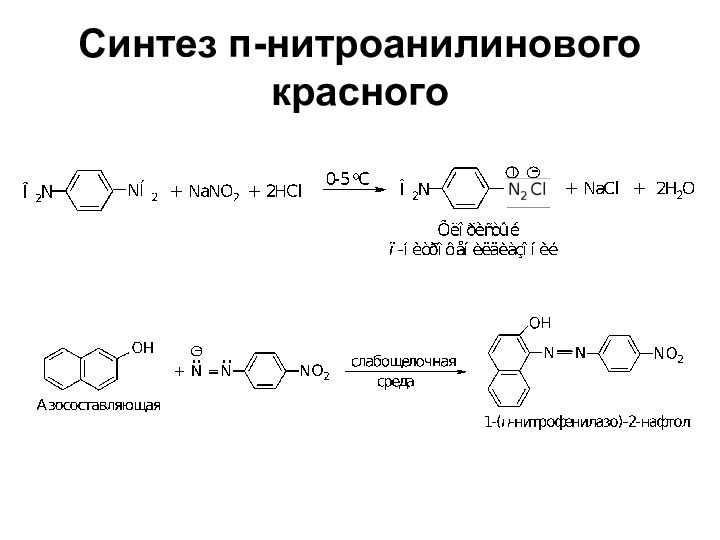
- 73. Синтез п-нитроанилинового красного
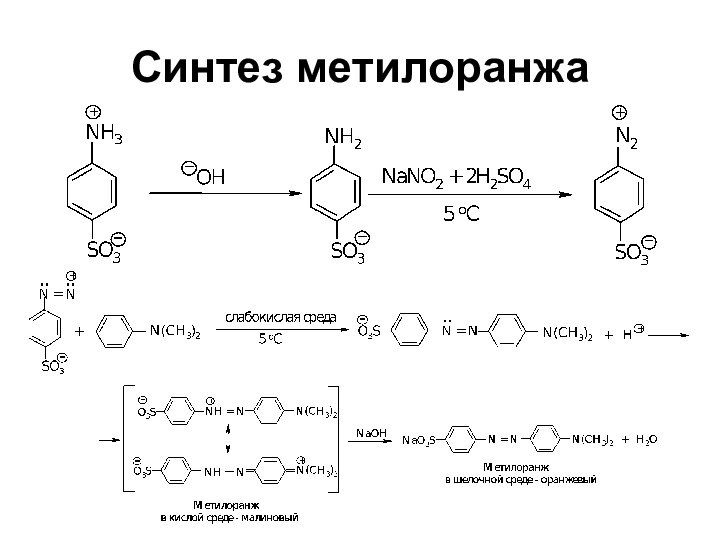
- 74. Синтез метилоранжа
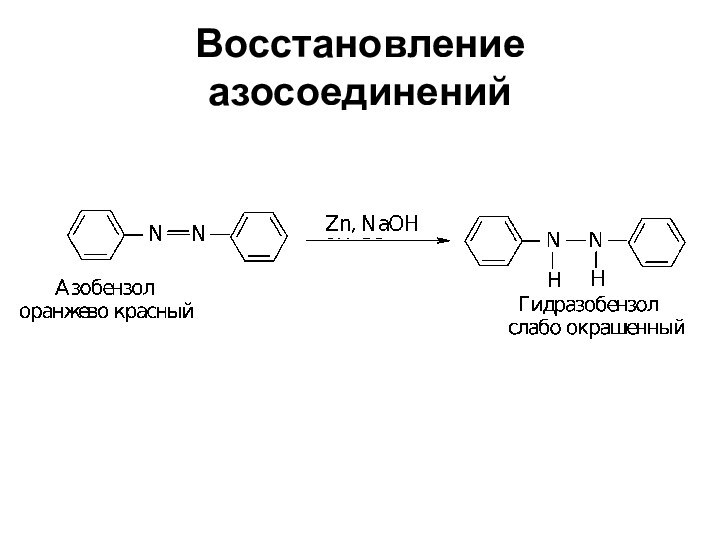
- 75. Восстановление азосоединений
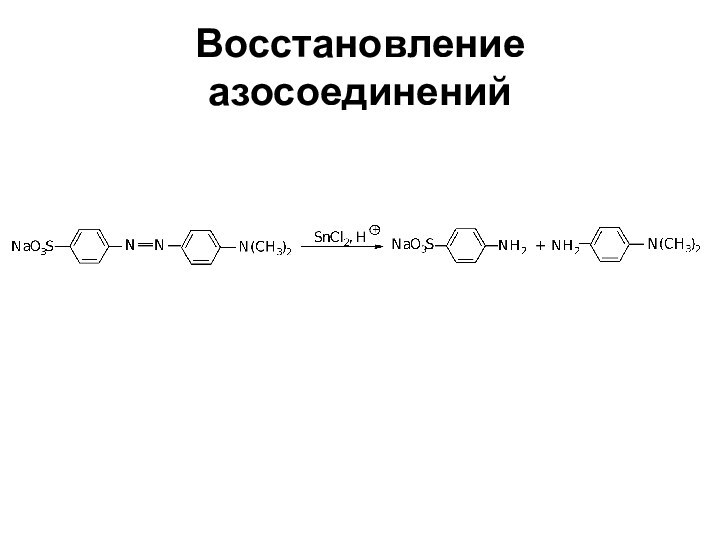
- 76. Восстановление азосоединений
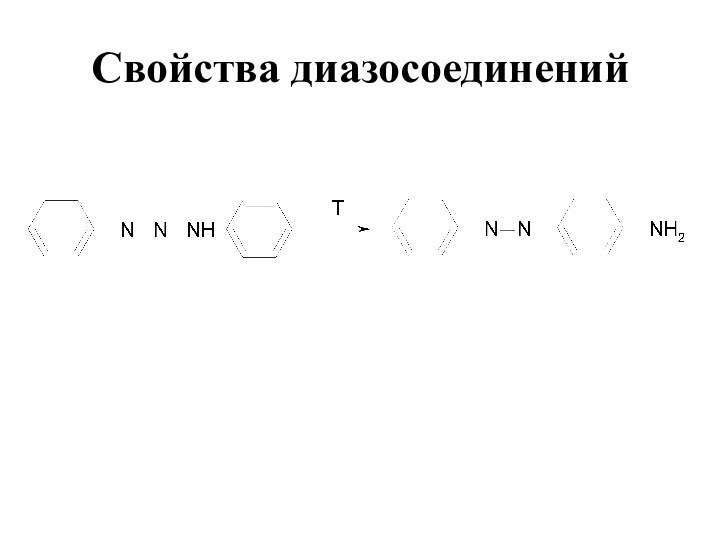
- 77. Свойства диазосоединенийДля первичных и вторичных ароматических аминов азогруппа вступает не в ароматическое кольцо, а в аминогруппу:
- 78. Свойства диазосоединений
- 79. Свойства диазосоединений
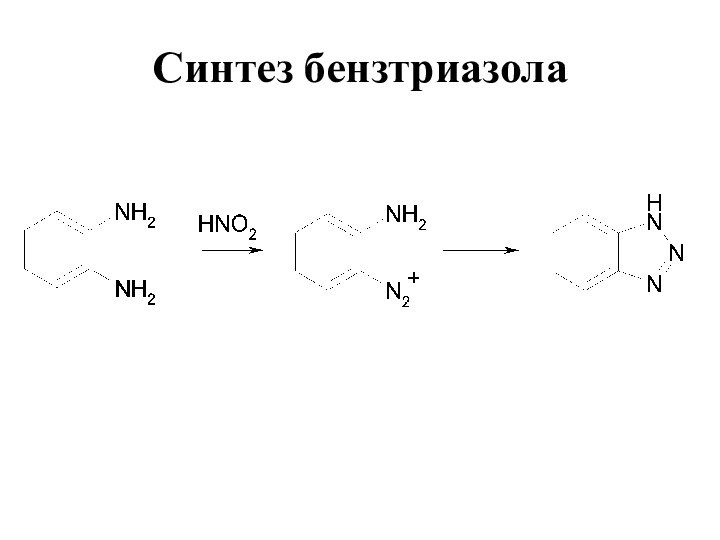
- 80. Синтез бензтриазола
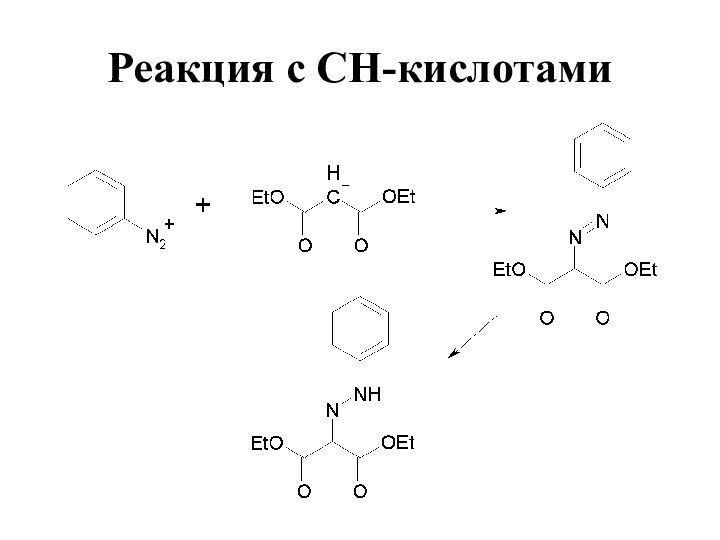
- 81. Реакция с СН-кислотами
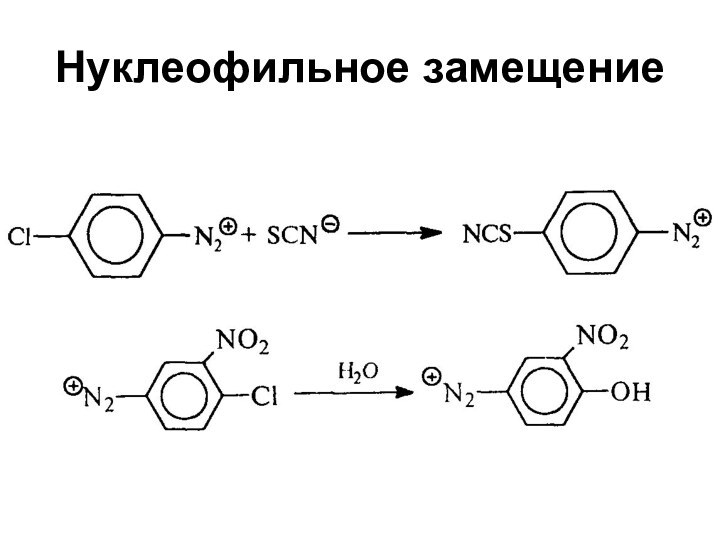
- 82. Нуклеофильное замещение
- 83. Скачать презентацию
- 84. Похожие презентации
Амины (органические производные аммиака)






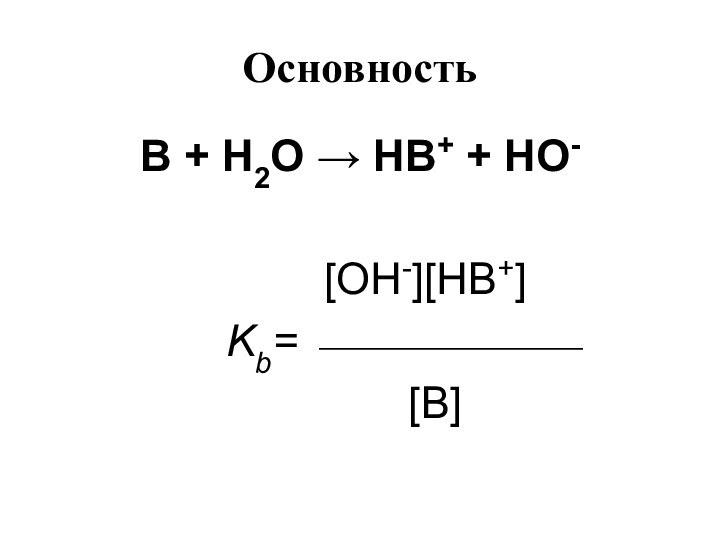









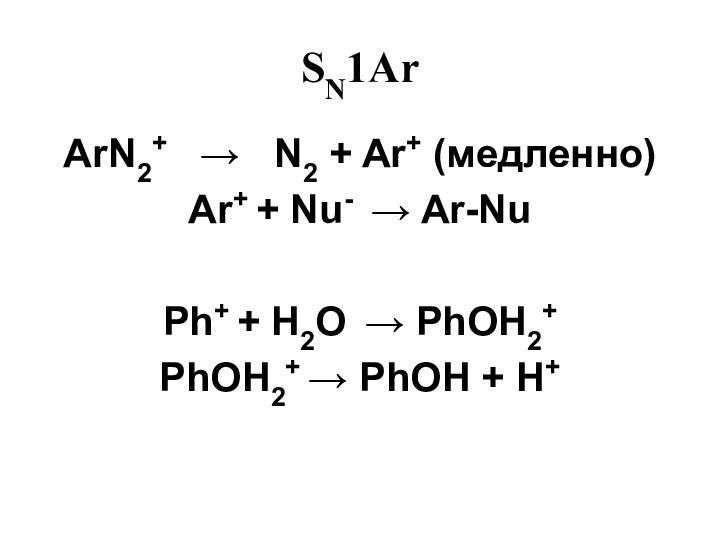
![Амины (органические производные аммиака) SN1Ar1) Скорость не зависит от [Nu]2) Влияние заместителей в ароматическом](/img/tmb/14/1313224/5fd3db635ad0ce44c7d40579298c05de-720x.jpg)




![Амины (органические производные аммиака) Свойства диазосоединенийArN2+ + [Н] ArNHNH2](/img/tmb/14/1313224/19860be18436abde43f50b8719413538-720x.jpg)







Слайд 11
Расщепление амидов по Гофману (укорачивание цепи)
ArСОNH2 + NaOCl
ArNH2 + Na2CO3 + NaBr + Н2О
Слайд 12
Физические свойства
Ароматические амины – жидкости или твердые тела
с характерным неприятным запахом, сильно токсичны
В воде растворяются мало,
накопление аминогрупп ведет к увеличению растворимости
Слайд 13
Химические свойства
Амины являются основаниями
Амины способны выступать в качестве
нуклеофильных реагентов
Слайд 14
Основность аминов
ArNH2 + H2O ArNH3+ +
OH-
раствор лакмуса окрашивают в синий цвет, фенолфталеина - в
малиновый
Слайд 18
Основность (pKBH+)
NH3 9.21
CH3NH2 10.62 C2H5NH2 10.63
(CH3)2NH 10.71
(C2H5)2NH 10.98
(CH3)3N 9.76 (C2H5)3N 10.65
PhNH2 4.58
PhNHCH3 4.85
PhN(CH3)2 5.06
Слайд 24
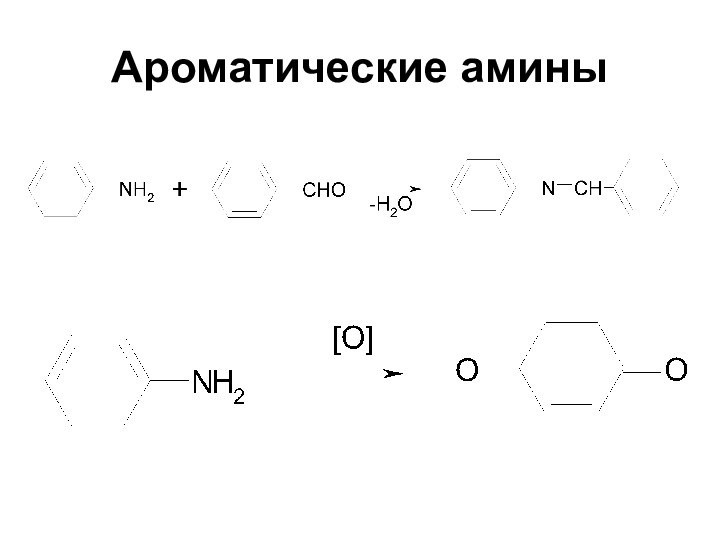
Ароматические амины
Первичные при взаимодействии с азотистой кислотой
дают соли диазония:
PhNH2HCl + НОNO
[Ph-NN]Cl + 2
Н2О
Слайд 25
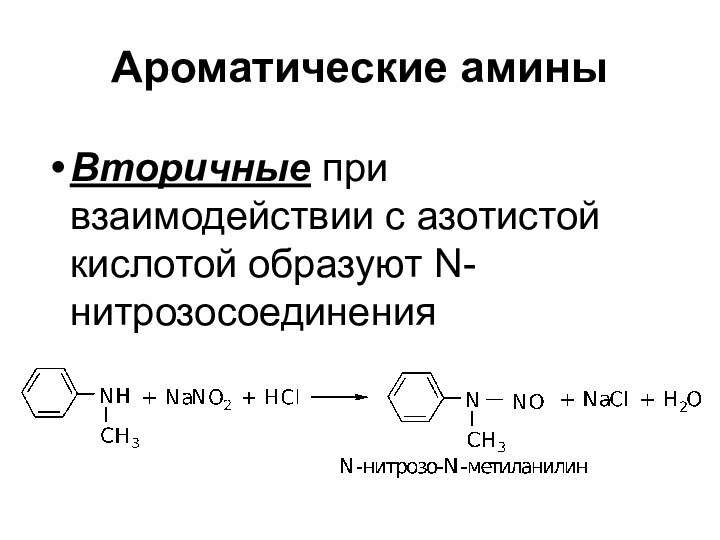
Ароматические амины
Вторичные при взаимодействии с азотистой кислотой
образуют N-нитрозосоединения
Слайд 26
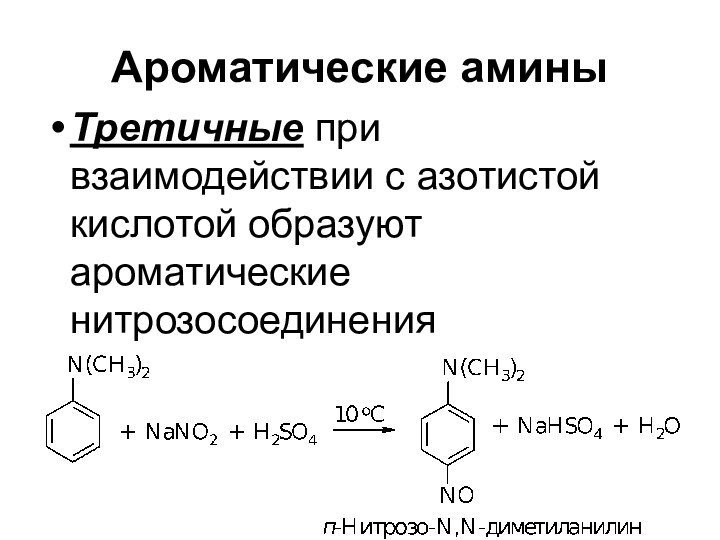
Ароматические амины
Третичные при взаимодействии с азотистой кислотой образуют
ароматические нитрозосоединения
Слайд 37
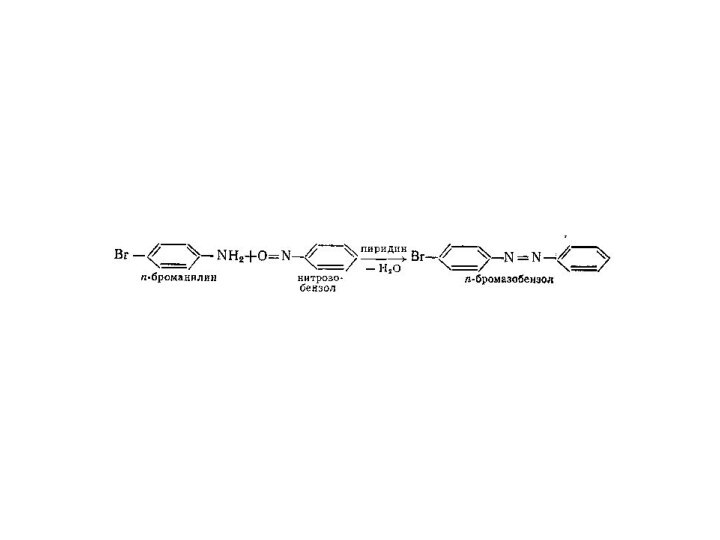
Диазосоединения
В которых группа –N2– связана с углеводородным радикалом
и неуглеводородным радикалом Х
Ar–N2X, где X = Br,
Cl, NO3, HSO4 - cоли диазонияAr–N2OH - диазогидрат