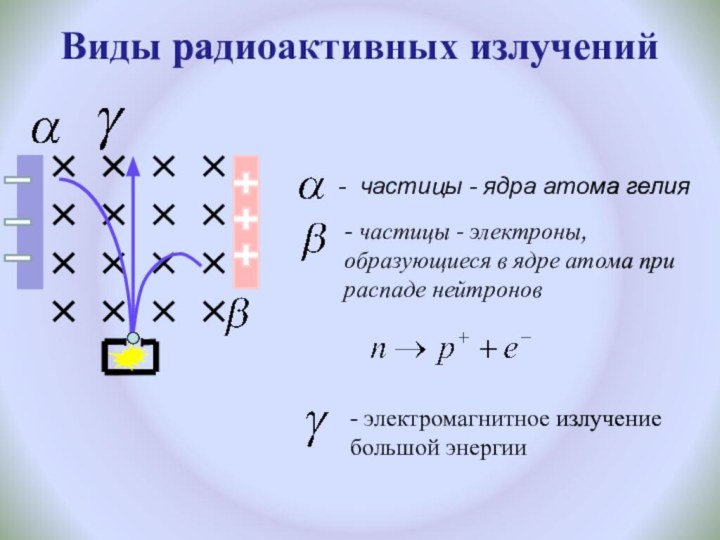
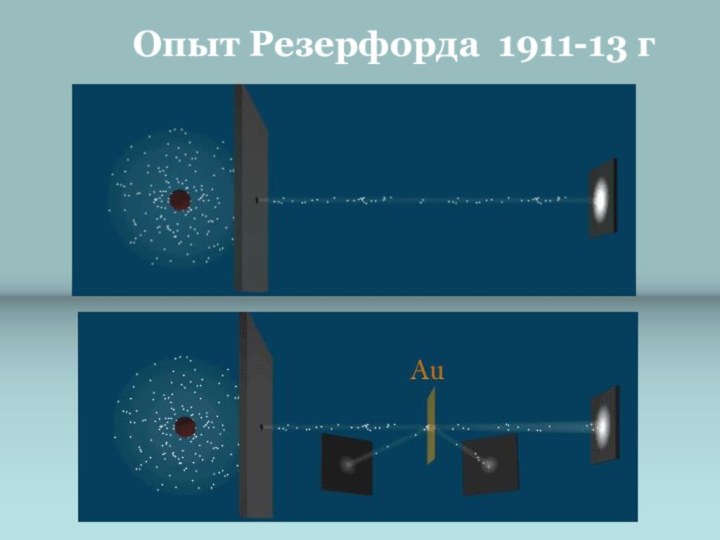
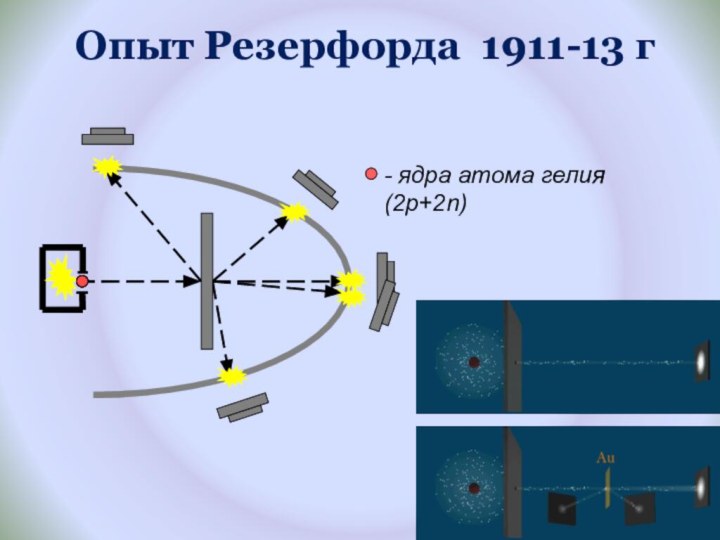
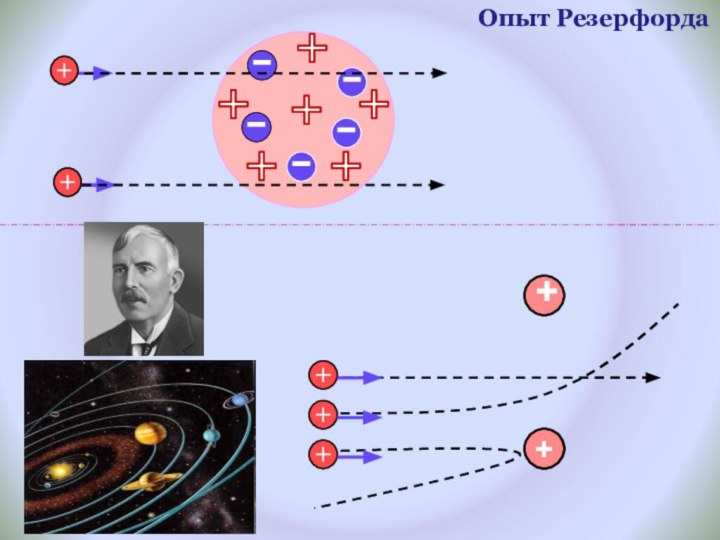
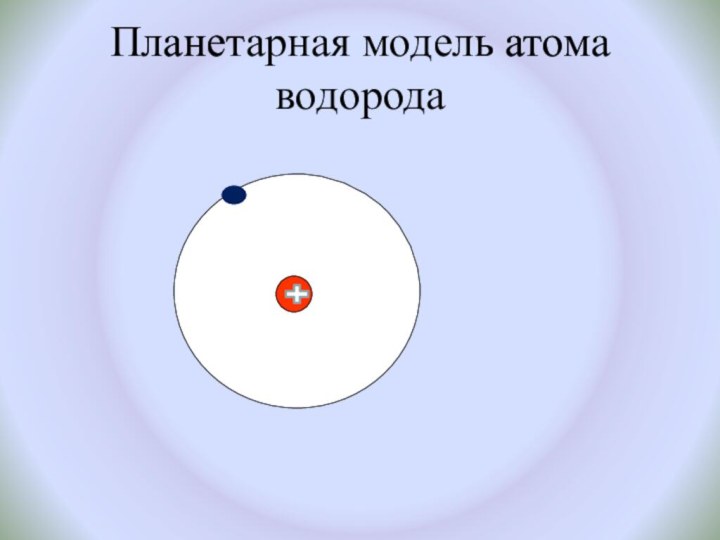
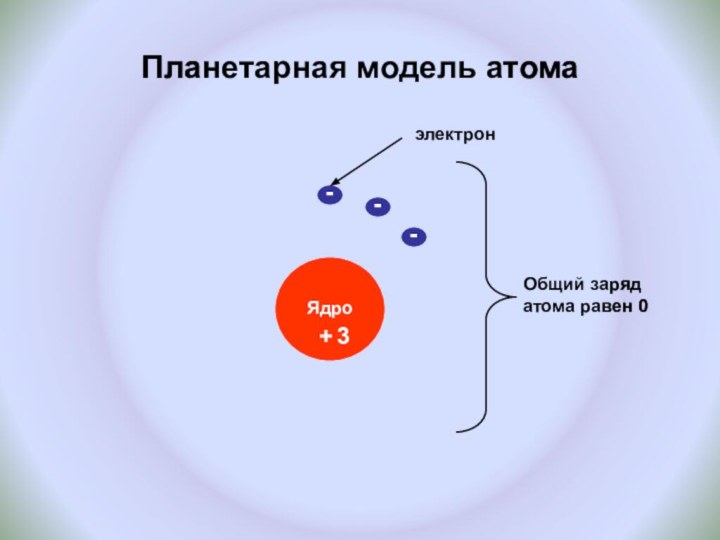
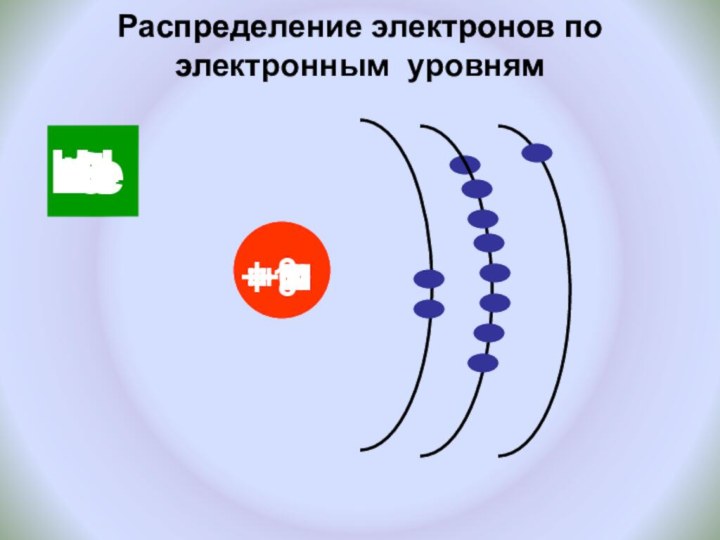
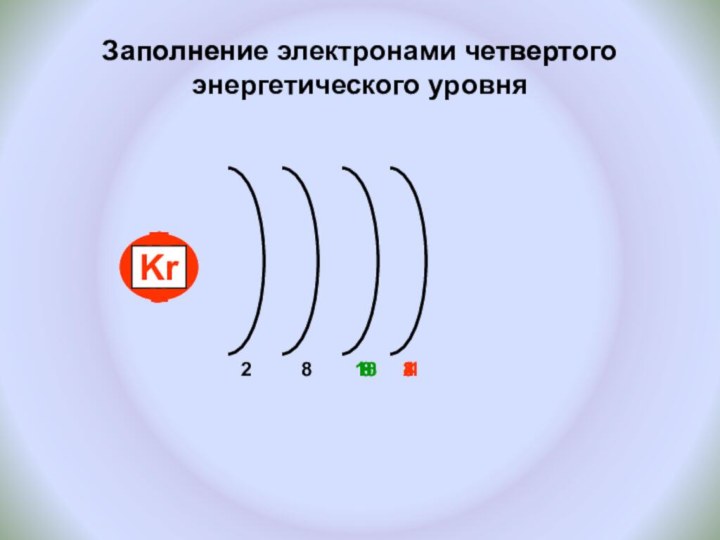
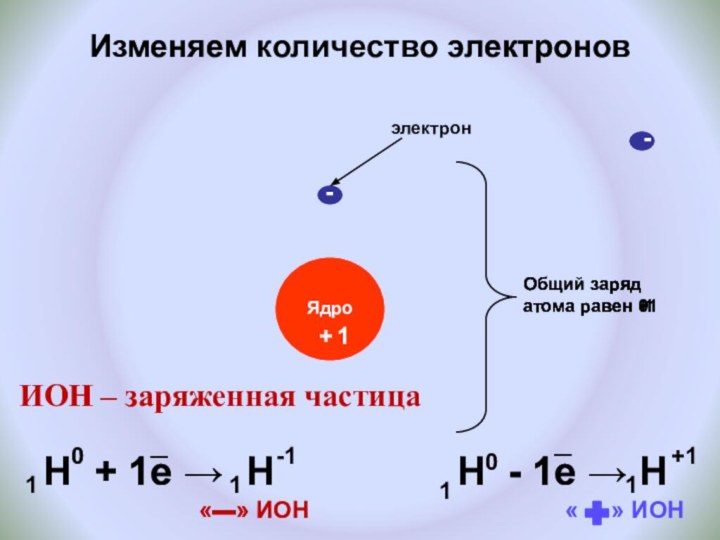
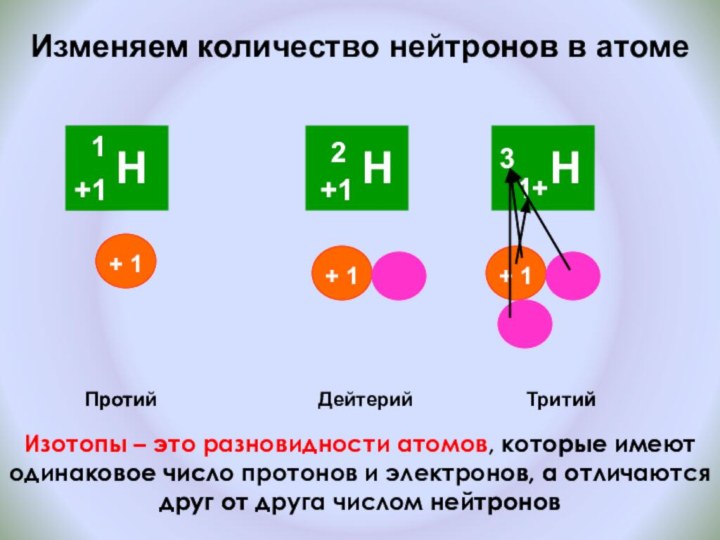
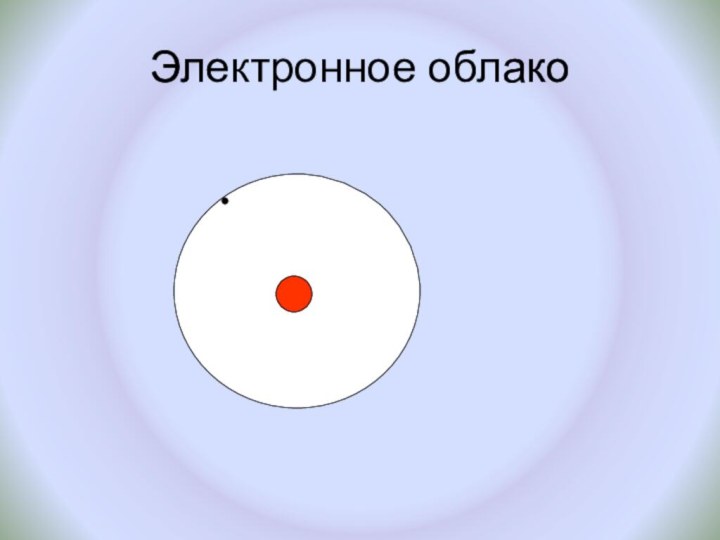
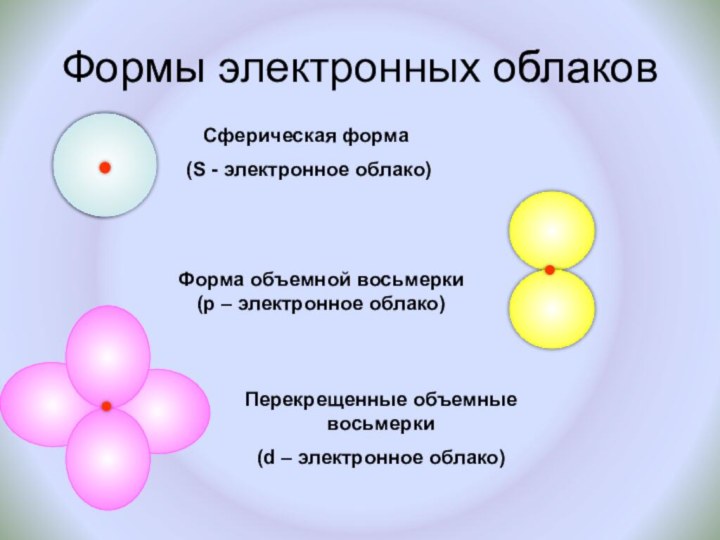
и показать единство законов физики и химии
Задачи:
Познакомить с историческими
фактами открытия атома и его сложного строения.Показать, что заряд ядра является главной характеристикой химического элемента.