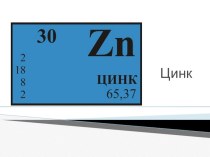
аммония;
Познакомиться с физическими свойствами, способами получения, распознавания аммиака и
солей аммония;Изучить химические свойства веществ.