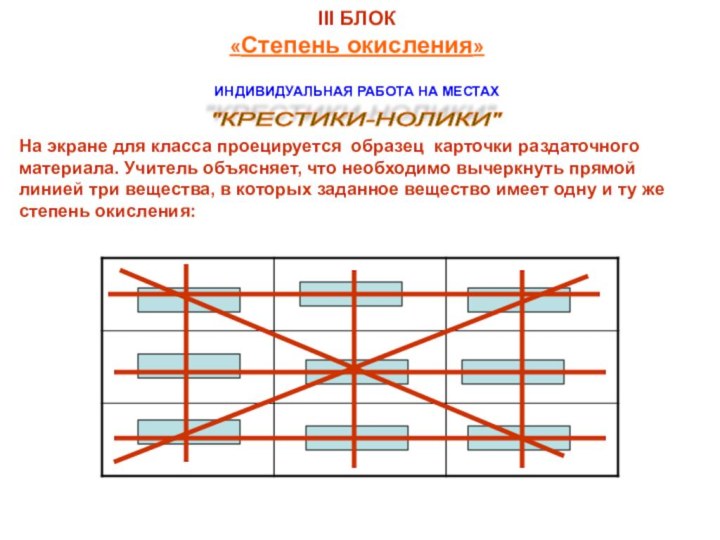
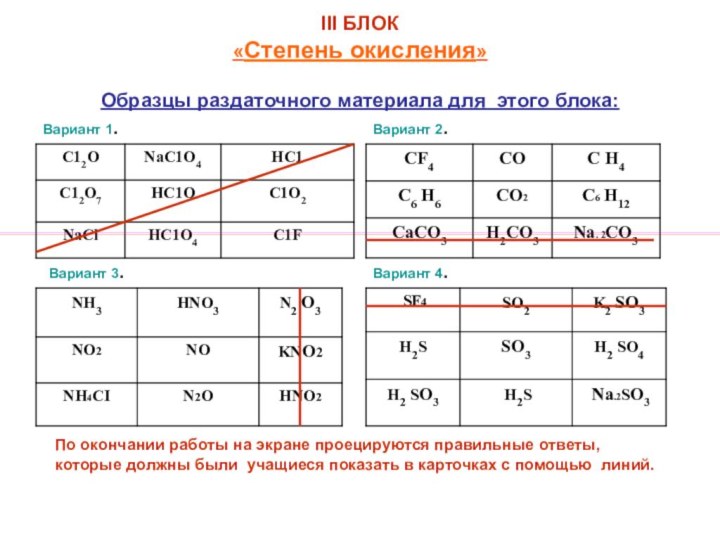
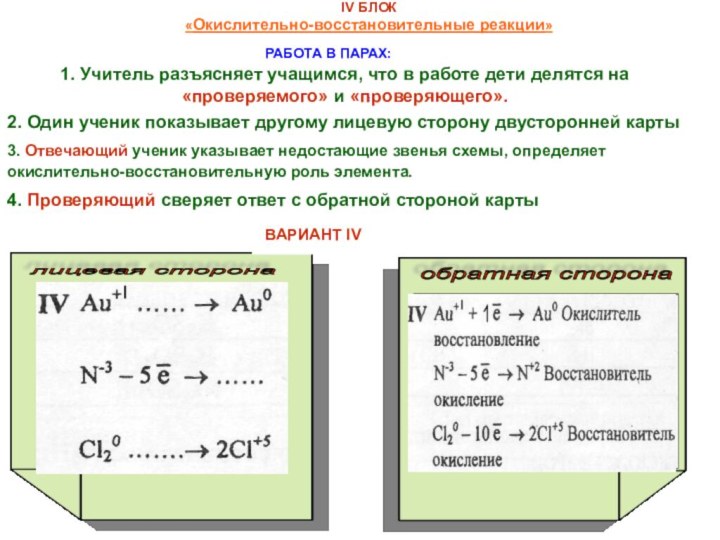
в VIII классе по следующим вопросам:
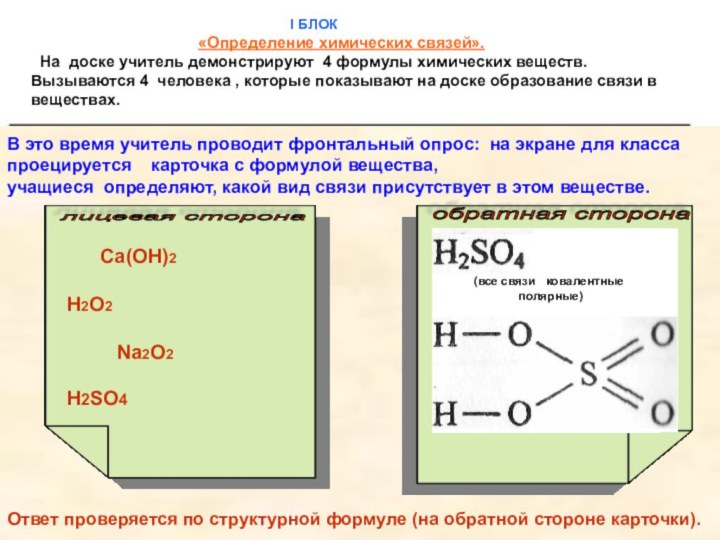
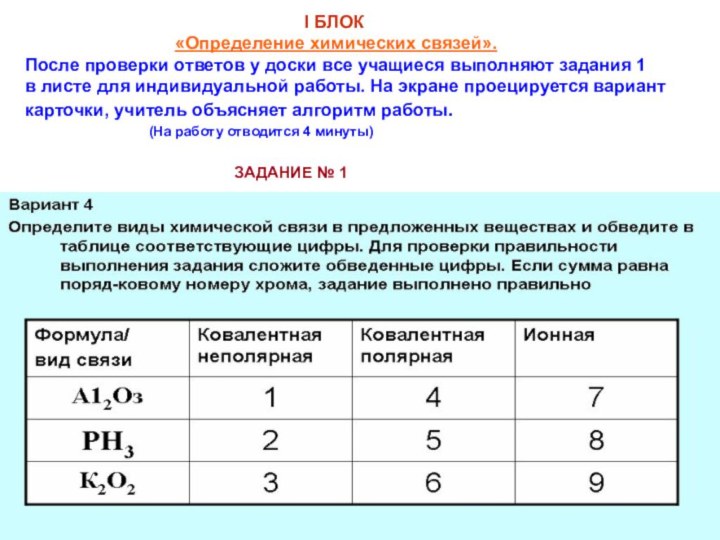
ковалентная связь, ее разновидности
и механизмы2) ионная связь;
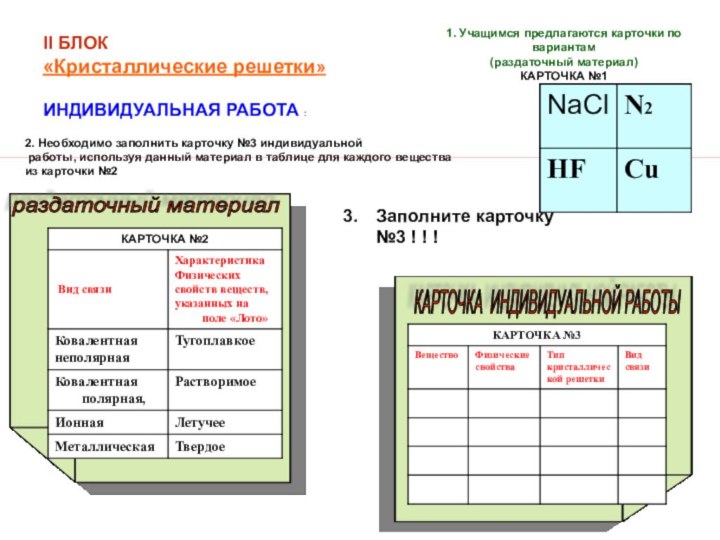
3) типы кристаллических решеток;
4) степень окисления;
5) понятие об окислительно-восстановительных
реакциях, электронный баланс.
Цели урока:
актуализировать знания и умения учащихся по теме;
обратить внимание на те вопросы, которые были недостаточно поняты, для наибольшей эффективности домашней подготовки к контрольной работе.