- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему АЦЕТИЛЕН И ЕГО ГОМОЛОГИ. СОСТАВ, СТРОЕНИЕ, ИЗОМЕРИЯ, СВОЙСТВА
Содержание
- 2. Тема урока: «Ацетилен и его гомологи. Состав, строение, изомерия, свойства, применение»
- 3. Цели урокана основе предложенных ресурсов: презентация, созданная
- 4. Изучение темы
- 5. Ресурсы Интернета http://cnit.ssau.ru/organics/index.htm
- 6. Цели уроказакрепить полученные знания:Выполнить задания с 1 по 6, находящиеся в слайдах презентации № 31-35
- 7. АЛКИНЫ Алкины (ацетиленовые углеводороды) – непредельные
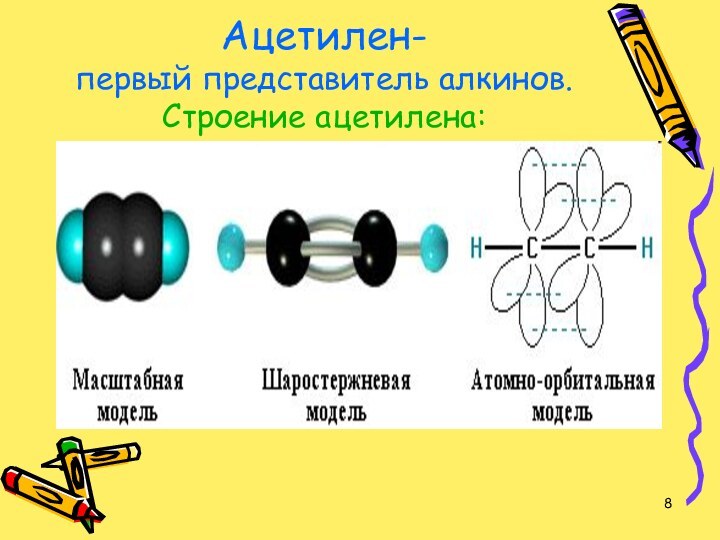
- 8. Ацетилен- первый представитель алкинов. Строение ацетилена:
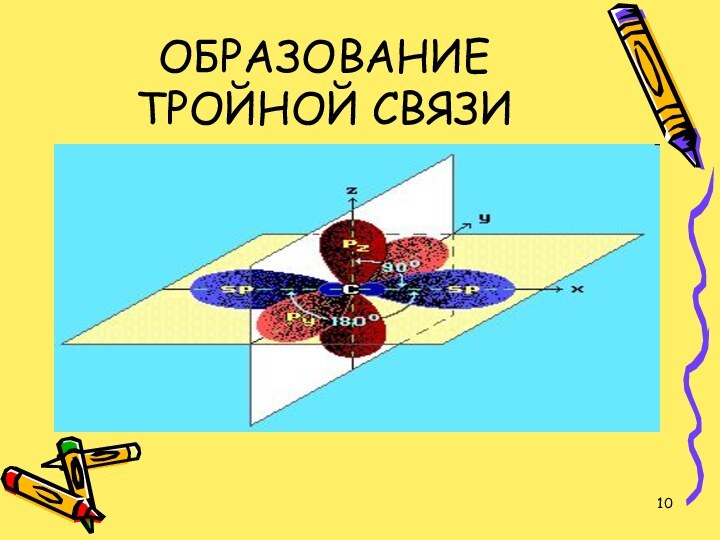
- 9. В молекуле ацетилена атомы углерода связаны тройной
- 10. ОБРАЗОВАНИЕ ТРОЙНОЙ СВЯЗИ
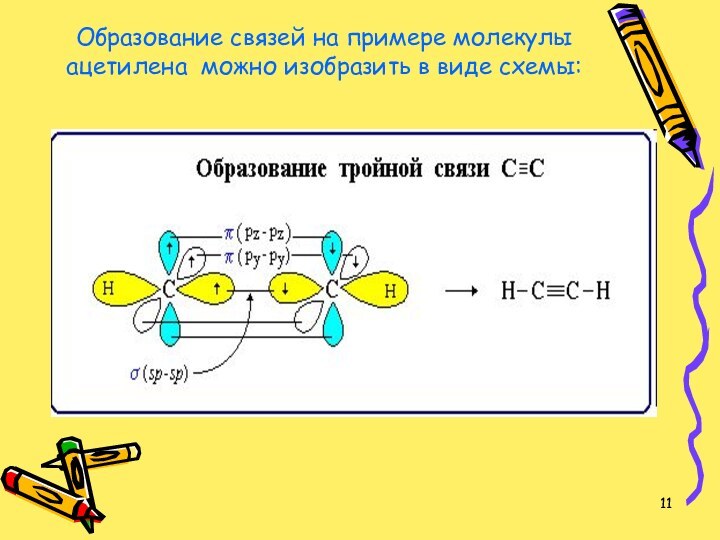
- 11. Образование связей на примере молекулы ацетилена можно изобразить в виде схемы:
- 12. АЛКИНЫОбщая формула алкинов СnH2n-2.Простейшие представители. Задание 2:
- 13. Номенклатура алкиновПо систематической номенклатуре названия ацетиленовых углеводородов
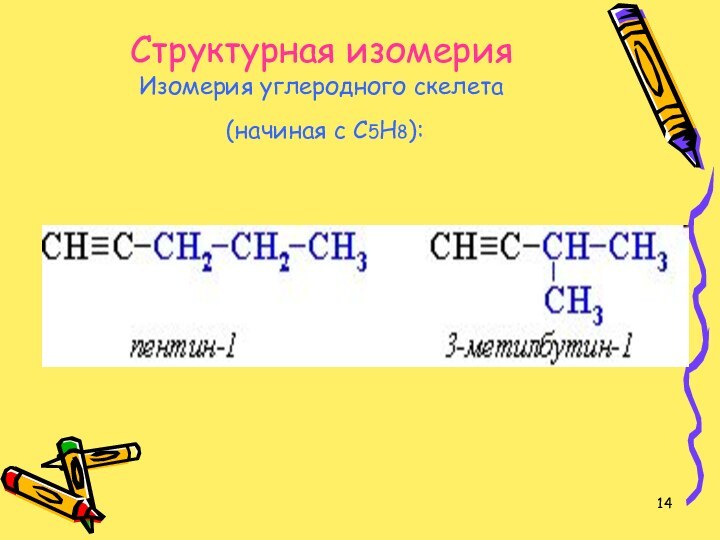
- 14. Изомерия алкинов Структурная изомерия Изомерия углеродного скелета (начиная с С5Н8):
- 15. Изомерия положения тройной связи (начиная с С4Н6):
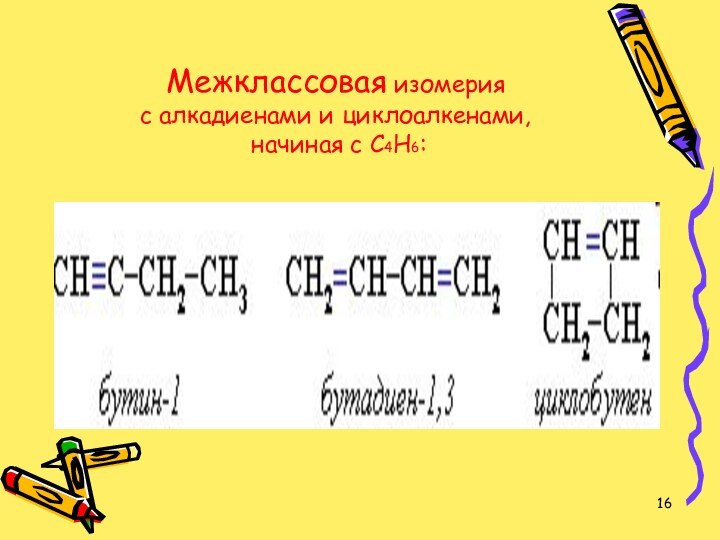
- 16. Межклассовая изомерия с алкадиенами и циклоалкенами, начиная с С4Н6:
- 17. Пространственная изомерия относительно тройной связи в
- 18. Физические свойстваТемпературы кипения и плавления ацетиленовых углеводородов
- 19. Химические свойства алкиновХимические свойства алкинов сходны с
- 20. Гидрирование В присутствии металлических катализаторов (Pt,
- 21. Галогенирование присоединение галогенов к
- 22. Гидрогалогенирование Присоединение галогеноводородов также идет по
- 23. Гидратация (реакция Кучерова) Присоединение воды происходит
- 24. ПолимеризацияТримеризация ацетилена над активированным углем приводит к образованию бензола (реакция Зелинского):
- 25. Окисление алкиновАцетилен и его гомологи окисляются
- 26. РЕАКЦИЯ ГОРЕНИЯ АЦЕТИЛЕНАПри сгорании (полном окислении)
- 27. Получение алкиновТермический крекинг метана: Гидролиз карбида кальция:
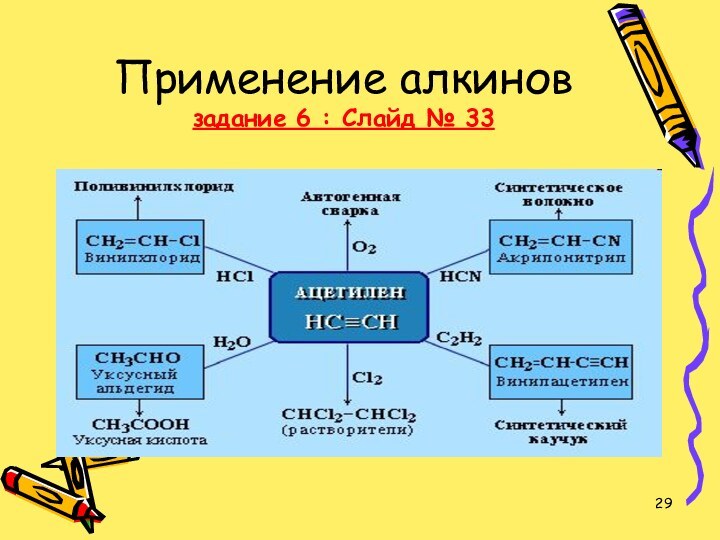
- 28. ПРИМЕНЕНИЕ АЛКИНОВНаибольшее значение среди алкинов имеет ацетилен.
- 29. Применение алкинов задание 6 : Слайд № 33
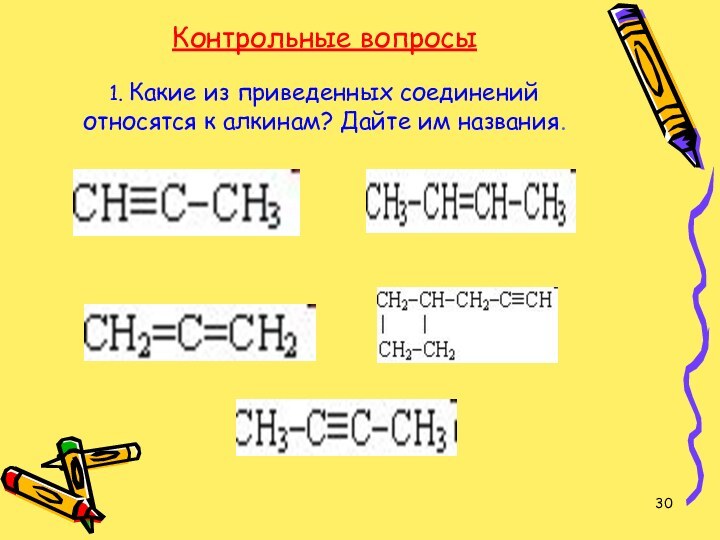
- 30. Контрольные вопросы 1. Какие из приведенных соединений относятся к алкинам? Дайте им названия.
- 31. 2. Какова гибридизация атомов углерода в следующей молекуле органического вещества?
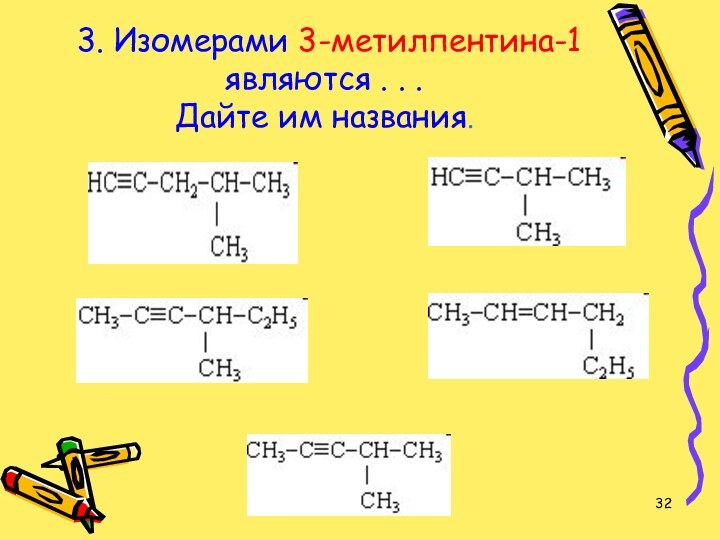
- 32. 3. Изомерами 3-метилпентина-1 являются . . . Дайте им названия.
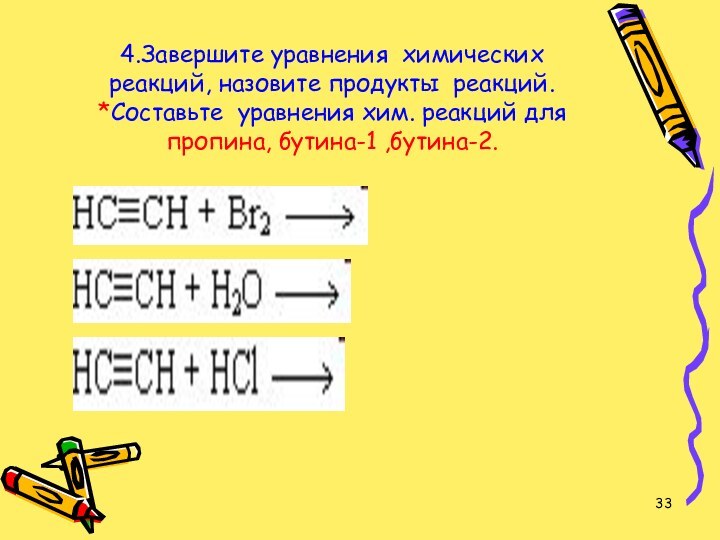
- 33. 4.Завершите уравнения химических реакций, назовите продукты реакций. *Составьте уравнения хим. реакций для пропина, бутина-1 ,бутина-2.
- 34. 5. Где применяется ацетилен и его гомологи?
- 35. Скачать презентацию
- 36. Похожие презентации
Тема урока: «Ацетилен и его гомологи. Состав, строение, изомерия, свойства, применение»




















Слайд 3
Цели урока
на основе предложенных ресурсов:
презентация, созданная в
Power Point,
Интернет-ресурсы,
«Виртуальная лаборатория. Химия 8-11 класс»
изучить
тему урока по предложенному плану
Слайд 4
Изучение темы урока по плану:
Состав: общая формула, простейшие
представители данного класса, номенклатура соединений.
Особенности строения: наличие тройной (кратной)
связи, тип гибридизации.Изомерия и ее виды.
Свойства веществ: физические и химические.
Применение.
Слайд 6
Цели урока
закрепить полученные знания:
Выполнить задания с 1 по
6, находящиеся в слайдах презентации № 31-35
Слайд 7 АЛКИНЫ Алкины (ацетиленовые углеводороды) – непредельные алифатические углеводороды, молекулы
которых содержат одну тройную связь.
Общая формула алкинов СnH2n-2.
Слайд 9
В молекуле ацетилена атомы углерода связаны тройной связью.
Тройная связь - это комбинация одной s- и двух
p-связей. Атомы углерода, входящие в состав молекулы ацетилена, находятся в состоянии sp-гибридизации.Задание 1: слайд № 30
Слайд 12
АЛКИНЫ
Общая формула алкинов СnH2n-2.
Простейшие представители.
Задание 2: С
помощью конструктора формул в «Виртуальной лаборатории. Химия 8-11 класс»
составить приведенные ниже формулы углеводородов.
Слайд 13
Номенклатура алкинов
По систематической номенклатуре названия ацетиленовых углеводородов производят
от названий соответствующих алканов (с тем же числом атомов
углерода) путем замены суффикса –ан на –ин:2 атома С ® этан ® этин; 3 атома С ® пропан ® пропин и т.д.
Главная цепь выбирается таким образом, чтобы она обязательно включала в себя тройную связь
Нумерацию углеродных атомов начинают с ближнего к тройной связи конца цепи. Цифра, обозначающая положение тройной связи, ставится обычно после суффикса –ин.
ЗАДАНИЕ 3: Слад № 29
Слайд 17
Пространственная изомерия относительно
тройной связи в
алкинах не проявляется,
т.к. заместители могут располагаться только
одним
способом - вдоль линии связи.Задание 4: Слайд № 31
Слайд 18
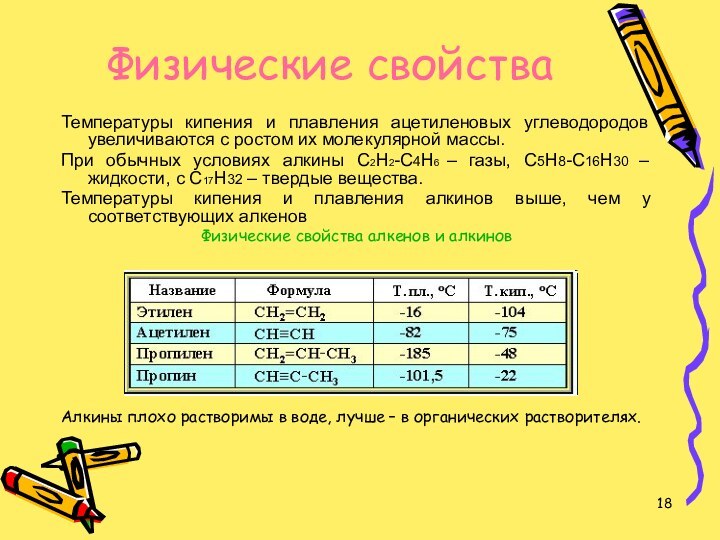
Физические свойства
Температуры кипения и плавления ацетиленовых углеводородов увеличиваются
с ростом их молекулярной массы.
При обычных условиях алкины
С2Н2-С4Н6 – газы, С5Н8-С16Н30 – жидкости, с С17Н32 – твердые вещества. Температуры кипения и плавления алкинов выше, чем у соответствующих алкенов
Физические свойства алкенов и алкинов
Алкины плохо растворимы в воде, лучше – в органических растворителях.
Слайд 19
Химические свойства алкинов
Химические свойства алкинов сходны с алкенами,
что обусловлено их ненасыщенностью.
Характеристики связей в алкинах:
Некоторые
отличия в свойствах алкинов и алканов определяются следующими факторами.p-Электроны более короткой тройной связи прочнее удерживаются ядрами атомов углерода и обладают меньшей поляризуемостью (подвижностью).
Поэтому реакции присоединения к алкинам протекают медленнее, чем к алкенам.
Слайд 20
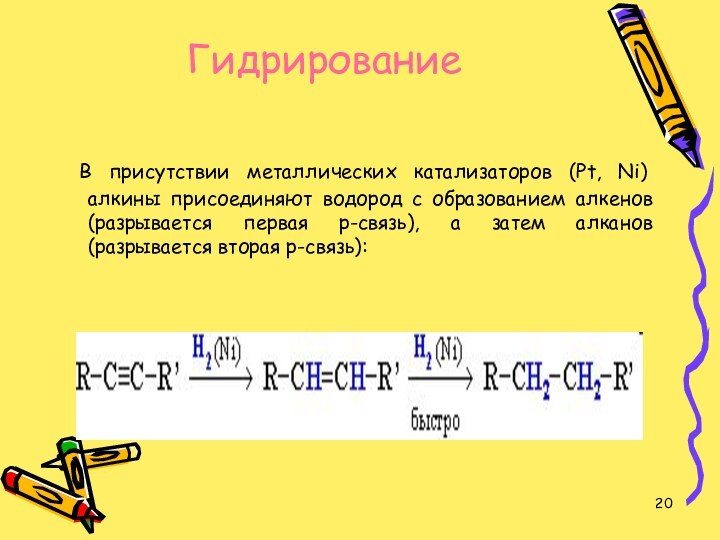
Гидрирование
В присутствии металлических катализаторов (Pt, Ni) алкины
присоединяют водород с образованием алкенов (разрывается первая p-связь), а
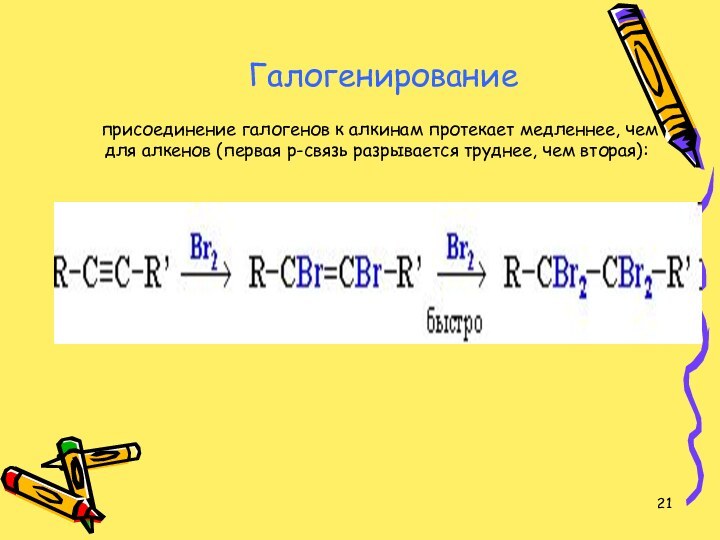
затем алканов (разрывается вторая p-связь):Слайд 21 Галогенирование присоединение галогенов к алкинам протекает медленнее,
чем для алкенов (первая p-связь разрывается труднее, чем вторая):
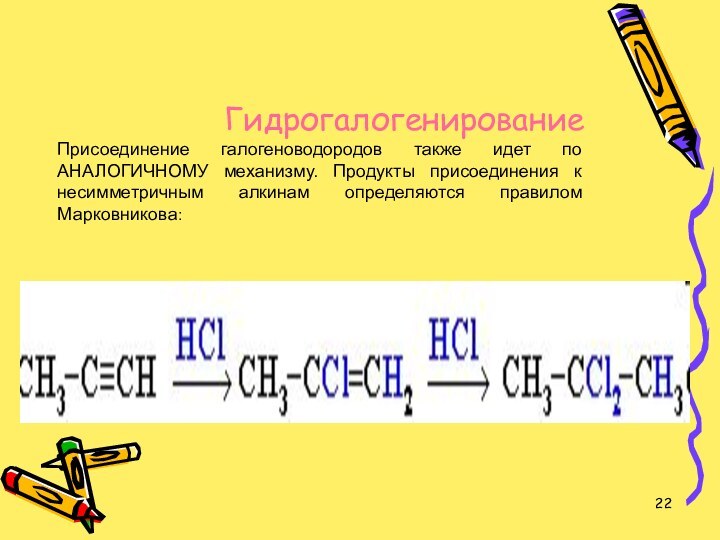
Слайд 22 Гидрогалогенирование Присоединение галогеноводородов также идет по АНАЛОГИЧНОМУ механизму.
Продукты присоединения к несимметричным алкинам определяются правилом Марковникова:
Слайд 23
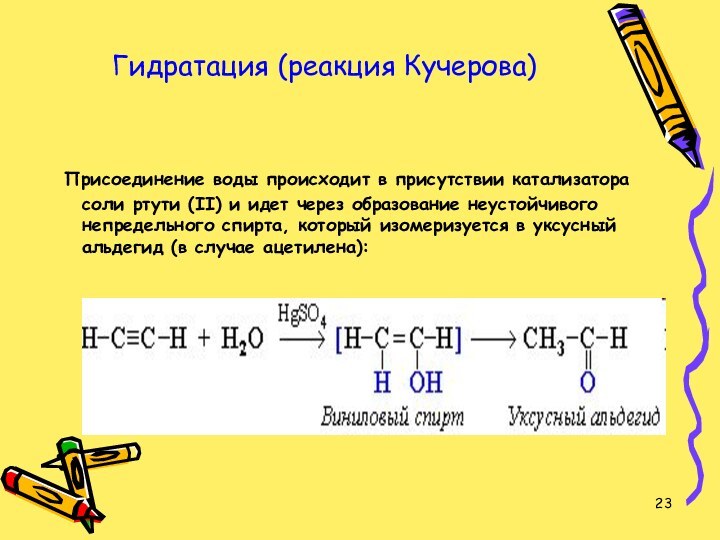
Гидратация (реакция Кучерова)
Присоединение воды происходит в присутствии
катализатора соли ртути (II) и идет через образование неустойчивого
непредельного спирта, который изомеризуется в уксусный альдегид (в случае ацетилена):
Слайд 24
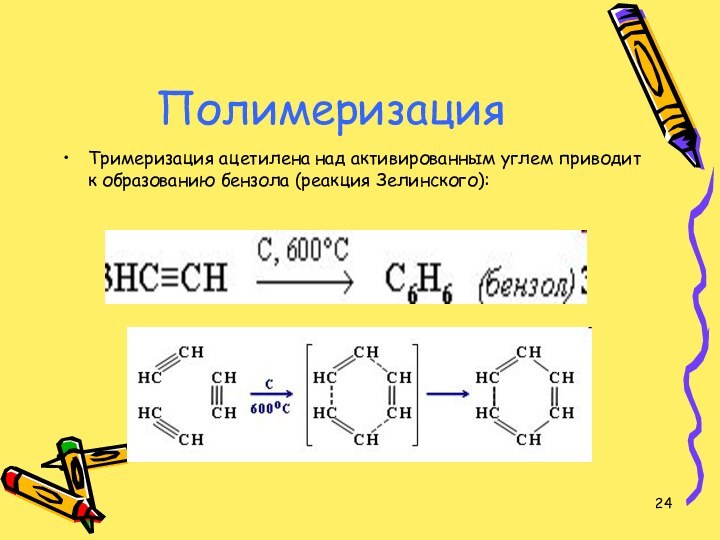
Полимеризация
Тримеризация ацетилена над активированным углем приводит к
образованию бензола (реакция Зелинского):
Слайд 25
Окисление алкинов
Ацетилен и его гомологи окисляются перманганатом
калия с расщеплением тройной связи и образованием карбоновых кислот:
Алкины обесцвечивают раствор KMnO4, что используется для их качественного определения.
Слайд 26
РЕАКЦИЯ ГОРЕНИЯ АЦЕТИЛЕНА
При сгорании (полном окислении) ацетилена
выделяется большое количества тепла:
Температура ацетиленово-кислородного пламени достигает 2800- 3000°С.
На этом основано применение ацетилена для сварки и резки металла. Ацетилен образует с воздухом и кислородом взрывоопасные смеси. В сжатом, и особенно в сжиженном, состоянии он способен взрываться от удара. Поэтому ацетилен хранится в стальных баллонах в виде растворов в ацетоне, которым пропитывают асбест.
Слайд 27
Получение алкинов
Термический крекинг метана:
Гидролиз карбида кальция:
Карбид кальция образуется при нагревании смеси оксида кальция СаО
(жженой извести) и кокса до 2500°С: Вследствие большой энергоемкости этот метод экономически менее выгоден.
Задание 5: Слайд № 32