Слайд 3
Белоктар
Белоктар - жоғары молекулалы азотты
косылыстар, а-амин кышқылдарынан (мономерден) түзілетін күрделі биополимерлер.
Қазіргі
кездегі түсінік бойынша белок
дегеніміз - молекулалық массасы 5000 Д
шамасынан артық, кеңістіктік құрылымы
бар және организмде белгілі бір қызмет
атқарады. Оның құрамында 50,6 – 54,5%
көміртек, 21,5 – 23,5% оттек, 6,5 – 7,3% сутек, 15 – 17,6% азот, 0,3 – 2,5% күкірт бар, кейде фосфор кездеседі. Осы элементтерден түзілетін амин кышқылдарының бір-бірімен байланысып қосылуы нәтижесінде белок молекуласы түзіледі. Белок молекуласының массасы өте үлкен, ол бірнеше мыңнан бірнеше миллионға дейін барады.
Слайд 4
Белоктар жөніңдегі ілім дамуының қысқаша тарихы
«Белок» деген термин

орыс тілінде жұмыртқаның ақ уызы деген сөзден шыққан. Белокқа
қатысты «цротеин» (грек тіліңде «ргоtеіоs» деген сөзден шыққан) деген термин де қолданылады.
Белок жөнінде ең алғаш ғылыми мәлімет берген голландиялық ғалым Мульдер болатын. Ол белоктың құрамында азот бар екенін анықтады және «протеин» деген терминді енгізді. деген белокгы бөліп алып зерттеді. Белоктарда пептидтік байланыс бар екенін неміс ғалымы Э. Фишер эксперимент жасап дәлелдеді (Ол 18 амин қышқылының қалдықтарынан құралған полипептидті химиялық жолмен синтездеді. Өткен ғасырдың 20-жылдары швед ғалымы Т. Сведберг белоктардьщ молекулалық массасын және тазалығын анықтау үшін алғашқы рет ультрацентрифугалау әдісін қолданады. Екінші швед ғалымы АЛизеллус үсынған белокгарды электрофорез өдісімен зерттеу бұл саладағы аса үздік табыс болды. И.П. Павловтың, әсіресе белоктардың ферменттік табиғатын анықтаған Дж. Самнердің , Дж. Нортроптың бағалы жүмыстарынан кейін белоктарды зерттеу кең көлемде қолға алывды. Белоктар биохимиясында Ф. Сенгер ашқан жаңалық дәуірлік қүбылыс болды. Ол полипептид тізбегівдегі амин қышқылдарының әрқашанда белгілі бір рет бойынша байланысатынын анықтады.
Слайд 5
Организмнің құрғақ затында белоктың мөлшері
Д.Л. Фердманның деректері бойынша мына төмендегідей болып келеді, %
алынған:
Көк бауыр 84% Жүрек 60%
Өкпе 82% Бауыр 57%
Бұлшық ет 80% Ми 45%
Бүйректер 72% Сүйектер 28 % Тері 63%
Белок қорғаныштық қызмет атқарады. Ол организмнің иммундық ауруға төтеп беру қасиеттерін жүзеге асырады.
Сонымен бірге белоктың тағы бір маңызды қызметінің бірі – оның құрылыс материалдары ретінде пайдаланылуы. Олар тіреу, бұлшықет және жабын тканьдерінің сүйек, шеміршек, сіңір, тері негізін құрайды. Белоктардың физикалық және химиялық қасиеттері организмнің тіршілік әрекетінің негізін құрайды.
Белоктар жоғары молекулалы органикалық қосылыстар. Табиғатына байланысты белоктардың молекулалық массасы барынша өзгере алады. Кең таралған белоктардың молекулалық массасын мына сандармен межелеуге болады : инсулин –35000, пепси –39000, гемоглобин –68000, жұмыртқа альбумині – 40500.
Слайд 6
Белоктардың жіктелуі
Ақуыздардың мынадай белгілеріне қарап
жіктейді:
Күрделілік дәрежесіне (қарапайым және күрделі), қарапайым протеиндер тек қана
аминқышқылдары қалдықтарынан тұрады, күрделі протеидтер құрамына ақуызды заттардан басқа қосылыстардың қалдықтары кіреді;
молекула пішініне (шар тәрізді және жіп тәрізді);
кейбір еріткіштерде еру қабілетіне қарай (суда еритіндер, әлсіз түз ерітінділерінде еритіндер - альбуминдер, спиртте еритіндер — проламиндер, сұйытылған қышқыл және сілті ерітінділерінде еритіндер глутелиндер);
атқаратын қызметтеріне қарай (мысалы, корға жиналатын ақуыздар, тірек қызметін атқаратын ақуыздар).
Слайд 7
Белок пішініне

сәйкес екі топқа бөлінеді:
1. Глобулярлы белоктар;
2. Фибриллярлы белоктар.
Глобулярлы белоктардың құрамында шағын ғана, олардың полипептидтік тізбектері сфера сияқты тығыздала бүктелген болады. Белок глобуласының бетіне негізінен амин қыщқылдарының полярлы тобы және зарядталған атомдары жинақталады. Олар сумен әрекеттесуге қабілетгі келеді. Глобулярлы белоктардың көпшілігі суда жане су ерітінділерінде ериді. Мұндай белоктарға барлық ферменттер, қанның, сүттің белоктары (альбуминдер, глобулиндер және басқалары) жатады.
Белок глобуласының ішкі бөлігі полярсыз ортаға жатады, ол гидрофобты және амин қышқылдарының полярсыз қалдықтарынан құралған. Гидрофобты ішкі ядроға су өтпейді, оның сумен байланысы жоқ, тығыз орналасқан.
Фибрнллярлы белоктар түріасты келеді. Суда және сулы ерітінділерде ерімейді. Белоктағы полипептидтік тізбектер белдік (ось) бойында өзара параллель орналасады, сөйтіп ұзын талшықтар - фибриллдер түзеді. Мұндай белоктардың молекуласы созылған жіп сияқты, бездері екі жөне одан көп полипептидтік тізбектерден тұрады. Тізбектері қатгы немесе созылмалы жұмсақ келеді және тірі организмде құрылымдық қызмет атқарады. Мұндай белоктарға коллаген - сіңір, сүйек, тері, тіс жөне шеміршек сияқты ұлпалардың негізі болып табылады. Шашта, жүнде, қауырсында, тырнақта, тұяқта кератин белогы бар, ал оған жібек фибрионы, қан фибриногені және тағы сол сияқты белоктар да жатады.
Слайд 8
Глобулярлы белоктардың құрылымы туралы айтылған материалдардан үш қорытынды
шығаруға болады.
а) Белок молекуласының үшіншілік конформациясын, оның
екіншілік құрылымы сияқты, биолипептид тізбегіндегі амин қышқылдар қалдығының бір-бірімен байланысты реттігі анықтайды.
б) Әр түрлі конформациясы бар белок мүлде басқа түрлі биологиялық кызмет атқарады.
в) Сәйкес конформациясы бар белоктар біртүрлі биологиялық қызмет атқарады.
Слайд 9
Екі немесе одан
да көп полипептидтік тізбектен тұратын белоктар олигомерлер деп, ал
полипептидтік тізбектер протомерлер немесе суббөліктер деп аталады. Суббөліктердің кеңістікте өзара орналасуын белоктың төртіншілік құрылымы деп атайды. Белоктың төртіншілік құрылымы едәуір күрделі конформация болып есептелінеді. Әр суббөліктің өзіне сәйкес екіншілік немесе үшіншілік құрылымы бар. Бір ғана полипептидтік тізбектен тұратын белоктармен салыстырғанда, олигомерлік белоктар күрделі қызмет атқарады. Мұндай күрделі қызмет атқаратын белокқа қан гемоглобині жатады. Қан гемоглобинінің әрқайсысы миоглобин сияқты 4 суббөліктен құралған.
Ол төртеуі біріншілік құрылымы бірдей тығыз сфералық құрылған екі а-суббөліктен және екі Р-суббөліктен тұрады.
Слайд 10
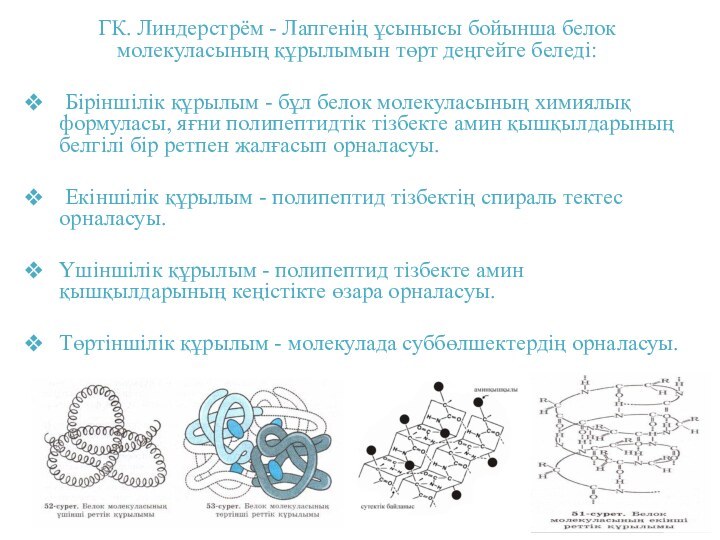
ГК. Линдерстрём - Лапгенің ұсынысы бойынша белок молекуласының
құрылымын төрт деңгейге беледі:
Біріншілік құрылым - бұл белок
молекуласының химиялық формуласы, яғни полипептидтік тізбекте амин қышқылдарының белгілі бір ретпен жалғасып орналасуы.
Екіншілік құрылым - полипептид тізбектің спираль тектес орналасуы.
Үшіншілік құрылым - полипептид тізбекте амин қышқылдарының кеңістікте өзара орналасуы.
Төртіншілік құрылым - молекулада суббөлшектердің орналасуы.
Слайд 11
Біріншілік құрылым
Белоктың біріншілік кұрылымы дегеніміз

- оның полипептидтік тізбегінде амин қышқьшдарының белгілі бір ретпен
жалғасып орналасуы. Осы жағдай генетикалық негізде детерминденген және белок молекуласының басқа құрылымының түзілуіндегі негізгісі болып табылады. Амин кышқылдарының тізбектегі кезектесуі бірдей белоктардың биологиялық қасиеттері, әдетте үқсас болып келеді. Керісінше, әр түрлі қызмет атқаратын белоктардың әдетте алғашқы құрылымы да әр түрлі. Кептеген улы затгардың да белоктық табиғаты бар және басқа белоктар сияқты олар да сол 20 амин қышқылынан құ ралады. Ал олардың у болатын себебі полипептидтік тізбекте амин қышқылдарының орналасуы басқаша болатындығында. Мысалы: азықтық, құрылымдық, транспорттық және өзге де белоктардың амин қышқылдары басқа тәртіппен орналасады.
Белоктардың біріншілік құрылымы пептидтік ковалентті және дисульфидтік байланысты Стардан құралады.
Лизоцим - тауық жұмыртқасының белогі, оның біріншілік құрылымы 1962 жылы анықталған, 124 амин қышқылы қалдықтарынан тұрады. М 14600, эллипсоид пішінді, төрт дисульфидтік байланыс бар. Лизоцим ферменттік қасиет керсетеді. Бактерия клеткасьшьщ полисахаридтен тұратын қабырғасын ерітіп жояды. Адамның, жануарлардың барлық мүшелерінде, кейбір өсімдіктерде болады. Бауырда, қарабауырда, сілекейде, көз жасында көп мөлшерде болады.
Микробтың токсиндері - ботулизм, сіреспе, дифтерия, тырысқақ токсиндері, жануарлардың - жылан, шаян, өрмекші токсиндері - өте улы заттар, белокқа жатады. Олар да белгілі 20 амин қышқылдарынан құралған, ал бір-бірімен жалғасу ретгері басқаша, сондықтан улы қасиет пайда болады. Мысал үшін төменде Оңтүстік Америка жыланының уы - нейротоксиннің біріншілік қүрылымы берілген. Ол 42 амин қышқыл қалдығынан тұрады.
Слайд 12
Екіншілік құрылым
Белок молекуласындағы полипептидтік тізбек

түзу емес, спираль тектес. Спиральдың бір айналымына 3,6 шамасындай
амин қышқылдарының қалдығы келеді, спиральдың әр қадамы 0,54 нм (3,6x0,15 нм). Белоктың осындай спираль тектес түрін оның екіншілік құрылымы деп атайды. Полипептидтік тізбектің мұндай орамды түрі а-спираль (Л. Полинг, Р. Корн, 1951 ж.) және Р-құрылымы (қатпарланған жапырақ) деп аталады. А-спираль және р-құрьшым түзейтін сутек байланыстары пептидтік топтау арқылы іске асқан.
Р-құрылым қалыптасуы қалай жүретіні туралы зерттеуіне назар аударайық. Олар амин қышқылдары мен пептидтер молекуласындағы бір-бірімен байланысқан атомдардьң арасындағы байланыс ұзындығьн және бұрыш мөлшерін зерттеген. Пептидтік топтарға С мен N арасындағы коваленттік байланыс қатты жазық құралған. Себебі карбонил көміртек атомы мен амин тобындағы азот атомының (С-N) байланысы ұзын, ұзындығы 0,132 нм, яғни дара ковалентгік байланыспен салыстырғанда (0,153нм) қысқа, бірақ қос байланыс (0,121нм) ұзындығынан сәл ұзын.
Осыдан кейін ғалымдар С—N арасындағы байланыс қос байланысқа жақын, оны былай жазуға болады деген: . Ал қос байланыс белдік (ось) арқылы айналуға жіберілмейді. Айналу үшін қос байланыстың біреуін үзу керек. Үзу үшін көп энергия (65ккал/моль) жұмсалса, белдік арқылы айналуға мүмкіндік береді.
Сондықтан арасындағы қатт ы байланысқан белдік айналу С~С, N-0 арасындағы дара ковалентік байланыстар белдік арқылы айналуға кедергі жасамайды, соның нәтижесінде полипептид тізбегінде пайда болып, әр түрлі спираль, құрылыс түзіледі.
Байланыс ұзындығы: С-С 0,153 нм
С-Н 0,1-32 нм
С=0 0 ,121 нм
N-0 0,147 нм
Слайд 13
Үшіншілік құрылым
Белоктьщ екіншілік құрылымьш түзетін спираль

түзу емес, ол аз кезегінде бұралып иіледі. Ондай буралу
кейде өте күрделі құрылым жасайды. Егер полипептидтік тізбектегі барлық атомдардың кеңістікте шаппіағьш глобула жасап орналасуы белоктың үшіншілік құрылымы деп аталады.
Белок молекуласы пішініндегі иіліп бұралу, қат-қабат қатпарлар, қисық бұрылыстар негізінен төмендегідей коваленттік емес әрекеттесуге байланысты:
1. амин қышқылдар қалдықтары арасындағы сутектік байланыс, мысалы, треозин мен глутамин қышқылының арасындағы байланыс;
2. қарама-қарсы зарядтары бар бүйірлік топтардың өзара әрекеттесуінің электростатикалық күштері (лизин мен аргинин, глутамин қышқылы мен аспарагин қышқылы);
3. амин қышкылдарындағы полярсыз радикалдар арасындағы гидрофобтық әрекеттесу;
4. белок молекуласындағы металл иондарының және амин қышқылдарындағы бүйірлік топтардың озара әрекеттесуі.
Миоглобиннің (Дж. Кендрью) және гемоглобиннің (М. Перут) үш жақты құрылымы рентген құрылымдық әдіспен зерттелген болатын.
Слайд 14
Белоктың полипептидтік тізбегінде а-спираль
мен Р-құрылымның өзара орналасу схемасы.
А. а-спиральдан құралған гемоглобиннің Р-суббөлшегі
Б. р-құрьшымнан құралған иммуноглобиннің константа домені.
В. а-спиральдан, р-құрьшымнан түзілген тауық жұмыртқасының лизоцимі. а-спираль лента түрінде көрсетілген. Р-құрылым К-соңынан бастап
С-соңына дейін стрелкамен берілген.
Слайд 15
Төртіншілік құрылым
Екі немесе одан да көп

полипептидтік тізбектен тұратыш белоктар полигомерлер деп, ал полипептидтік тізбектер
протомерлер немесе суббөліктер деп аталады. Суббөліктердің кеңістікте өзара орналасуын белоктың төртіншілік құрылымы деп атайды. Белоктың төртіншілік құрылымы едәуір күрделі конформация болып есептелінеді. Әр суббөліктің (протомердің) өзіне сәйкес екіншілік немесе үшіншілік құрылымы бар. Бір ғана полипептидтік тізбектен тұратын белоктармен салыстырғанда, олигомерлік белоктар күрделі қызмет атқарады. Мүндай күрделі қызмет атқаратын белокқа қан гемоглобині жатады. Қан гемоглобинінің әрқайсысы миоглобин сияқты 4 суббөліктен құралған.
Ол төртеуі біріншілік құрылымы бірдей тығыз сфералық құрылған екі а-суббөліктен және екі Р-суббөліктен тұрады.
2.14. Суретте гемоглобиннің тұтас молекуласының моделі көрсетілген.
Көптеген ферментгердің, М және А иммуноглобулиндердің және тағы басқа белоктардың молекулалары төртіншілік құрылымнан құралған.
көрсетілгендей белок молекуласының төртіншілік құрылымы екі, үш, төрт суббөліктерден, одан да көп, 12, (глутаминсинтетаза), 24 (апоферритин) полипетидтік тізбектерден тұрады екен.
Әр протомердегі бүйірлік топтар арасындағы электростатикалық жөне сутектік байланыстар арқылы суббөліктер бір-бірімен қосылады.
Слайд 16
2.14- сурет. 4 суббөліктен құралған гемоглобин молекуласьшың моделі.
Оның молекуласы сфера пішінді, диаметрі 5,5 нм. Гем әрбір
суббөліктің тереңінде орналасқан. Оның гидрофильді бөліктері (пропионат) лизин мен аргининнің оң зарядталған қалдықтарымен ерекеттескен. Гидрофобты бөліктері (пиррол сақинасы) амин қышқьшдарының полярсыз топтарымен
байланысқан.
Слайд 17
Химиялық қасиеттері
Құрамы мен құрылысы күрделі

болғандықтан, ақуыздардың қасиеттері де алуан түрлі. Олардың құрамында әртүрлі
химиялық реакцияларға түсетін функционалдық топтары бар.
Ақуыздар — екідайлы электролиттер. Ортаның белгілі бір рН мәнінде олардың молекулаларындағы оң және теріс зарядтар бірдей болады. Бұл — ақуыздардың маңызды қасиеттерінің бірі. Бұл нүктеде ақуыздар электрбейтарап болып, суда еруі азаяды. Ақуыздардың осы қасиеті технологияда ақуызды өнімдер алуға қолданылады.
Ақуыздардың гидролизі. Сілті немесе қышқыл ерітінділерін қосып қыздырғанда, ақуыздар гидролизденіп, аминқышқылдарын түзеді.
Ақуыздардың түсті реакциялары. Белоктарды сапалық анықтау үшін түсті реакциялар қолданылады.
а) Ксантопротеинреакциясымен (грек. ксанты — сары) құрамында бензол ядросы бар ақуыздар концентрлі азот қышқылымен сары түс береді.
ә) Биурет реакциясы. Мыс (II) гидроксидінің сілтідегі ерітіндісімен ақуыздарға әсер еткенде, ашық күлгін түс пайда болады. Бұл реакция ақуызтардың құрамындағы пептидтік байланыстарды анықтайды.
б) Құрамында күкірті бар ақуыздарға қорғасын ацетатын және сілті қосып қыздырғанда, қорғасын сульфидінің қара тұнбасы түзіледі.
Слайд 18
Қорытынды
Белок, протеиндер – күрделі молекулалы табиғи органикалық қосылыстар.
Белок тек тірі организмдер құрамында ғана болады. Оның құрамында
50,6 – 54,5% көміртек, 21,5 – 23,5% оттек, 6,5 – 7,3% сутек, 15 – 17,6% азот, 0,3 – 2,5% күкірт бар, кейде фосфор кездеседі. Осы элементтерден түзілетін амин кышқылдарының бір-бірімен байланысып қосылуы нәтижесінде белок молекуласы түзіледі. Белок молекуласының массасы өте үлкен, ол бірнеше мыңнан бірнеше миллионға дейін барады. Белоктар туралы алғашқы мәліметтер 18 ғасырдан белгілі.