- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему к уроку химии на тему Серная кислота
Содержание
- 2. Мозговой штурмЧто вам известно о серной кислоте?
- 3. Молекулярная формула H2SO4
- 4. Серная кислота H2SO4 — сильная двухосновная кислота, отвечающая
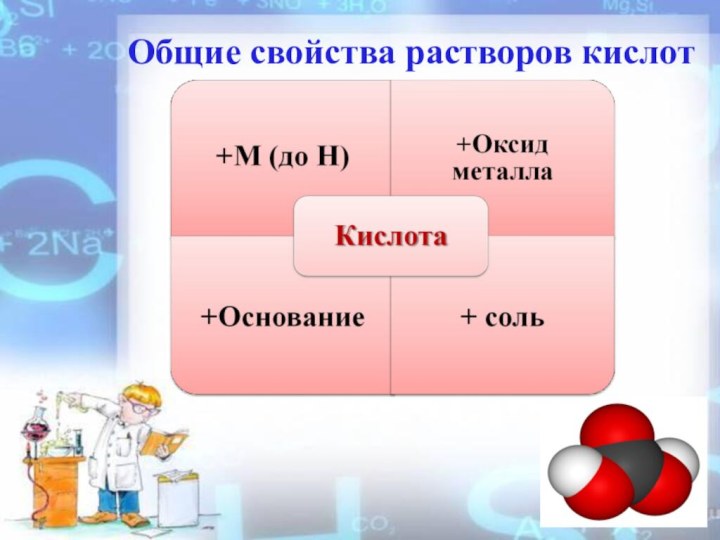
- 5. Общие свойства растворов кислот
- 6. Самостоятельная работаСоставьте уравнения реакций:1) Диссоциация серной кислоты2)
- 7. Взаимопроверка1. Диссоциация:H2SO4 ↔ H+ + HSO4-HSO4-
- 8. 3. Взаимодействие с оcновными и амфотерными оксидамиCuO
- 9. 4. Взаимодействие с основаниями и амфотерными гидроксидами
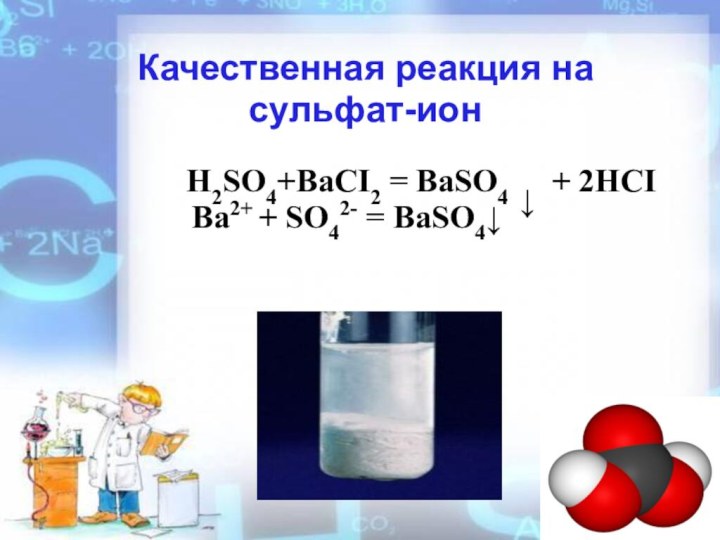
- 10. 5.Взаимодействие с солями H2SO4+BaCI2 = BaSO4 ↓
- 11. Качественная реакция на сульфат-ионH2SO4+BaCI2 = BaSO4 ↓ + 2HCIBa2+ + SO42- = BaSO4↓
- 12. Концентрированная H2SO4 – сильный окислительпри взаимодействии
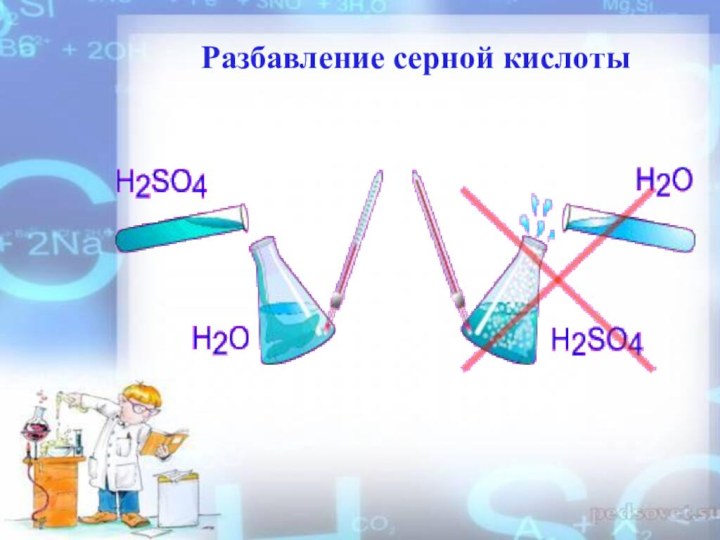
- 13. Разбавление серной кислоты
- 14. Применение серной кислоты Серную кислоту применяют:В
- 15. ДОМАШНЕЕ ЗАДАНИЕ§ 21; материалы электронного приложенияВыполните 2-3
- 16. Скачать презентацию
- 17. Похожие презентации
Мозговой штурмЧто вам известно о серной кислоте?













Слайд 4 Серная кислота H2SO4 — сильная двухосновная кислота, отвечающая высшей
степени окисления серы (+6).
кислота — тяжёлая маслянистая жидкость без цвета и запаха.
Слайд 6
Самостоятельная работа
Составьте уравнения реакций:
1) Диссоциация серной кислоты
2) Zn
+ H2SO4 →
Cu + H2SO4
→3) CuO + H2SO4 →
ZnO + H2SO4 →
4) NaOH + H2SO4 →
Zn(OH)2 + H2SO4 →
5) H2SO4+BaCI2 →
K2CO3 + H2SO4 →
Слайд 7
Взаимопроверка
1. Диссоциация:
H2SO4 ↔ H+ + HSO4-
HSO4- ↔
H+ + SO42
2. Взаимодействие с металлами ( до
Zn
+ H2SO4 → ZnSO4 + H2↑Cu + H2SO4 → не реагирует
Слайд 8
3. Взаимодействие с оcновными и амфотерными оксидами
CuO +
H2SO4 → CuSO4 + H2O
CuO + 2H+ → Cu2+
+ H2OZnO + H2SO4 → ZnSO4 + H2O
ZnO + 2H+ → Zn2+ + H2O
Слайд 9
4. Взаимодействие с основаниями и амфотерными гидроксидами
2NaOH + H2SO4 → Na2SO4 +2
H2OH+ + ОН- → H2O
NaOH + H2SO4 → NaHSO4 +H2O
Кислая соль гидросульфат натрия
Zn(OH)2 + H2SO4 → ZnSO4 +2H2O
Zn(OH)2 + 2H+ → Zn2+ +2H2O
Слайд 10
5.Взаимодействие с солями
H2SO4+BaCI2 = BaSO4 ↓
+ 2HCI
Ba2++SO42- = BaSO4 ↓
K2CO3 + H2SO4
= K2SO4 + CO2 ↑+ H2O2H++ CO32- = CO2 ↑+ H2O
Слайд 12
Концентрированная H2SO4 – сильный окислитель
при взаимодействии с
металлами (кроме Au, Pt)
может восстанавливаться до SO2, H2S
или SMe + H2SO4 → соль + SO2↑ + H2O
2Ag + 2H2SO4 → Ag2SO4 + SO2↑+ 2H2O
8Na + 5H2SO4 → 4Na2SO4 + H2S↑ + 4H2O
Fe, Al, Cr (без нагревания) - пассивируются
Слайд 14
Применение серной кислоты
Серную кислоту применяют:
В производстве
минеральных удобрений;
Как электролит в свинцовых аккумуляторах;
Для получения различных минеральных
кислот и солей,В производстве химических волокон, красителей, дымообразующих веществ и взрывчатых веществ,
В нефтяной, металлообрабатывающей, текстильной, кожевенной и др. отраслях промышленности.
В пищевой промышленности зарегистрирована в качестве пищевой добавки E513(эмульгатор).
В промышленном органическом синтезе
Слайд 15
ДОМАШНЕЕ ЗАДАНИЕ
§ 21; материалы электронного приложения
Выполните 2-3 задания
(на выбор) стр.78:
― упражнение №2
―упражнение № 4
―задача № 5
―
тестовые задания3) Подготовьте презентацию «Кислотные дожди»





























