- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Электролитическая диссоциация 10 класс
Содержание
- 2. вещества, растворы и расплавы которых проводят электрический
- 4. Ионная или сильнополярная ковалентная связьОснованияКислотыСолиКовалентная неполярная или малополярная связьОрганические соединенияГазыНеметаллыЭлектролитыНеэлектролиты
- 5. Теория электролитической диссоциацииС. А. Аррениус (1859-1927)процесс растворения
- 6. 1. Электролиты при растворении в воде распадаются
- 9. Причины распада вещества на ионы в расплавах
- 10. Причины диссоциации веществ в воде 1. Вода
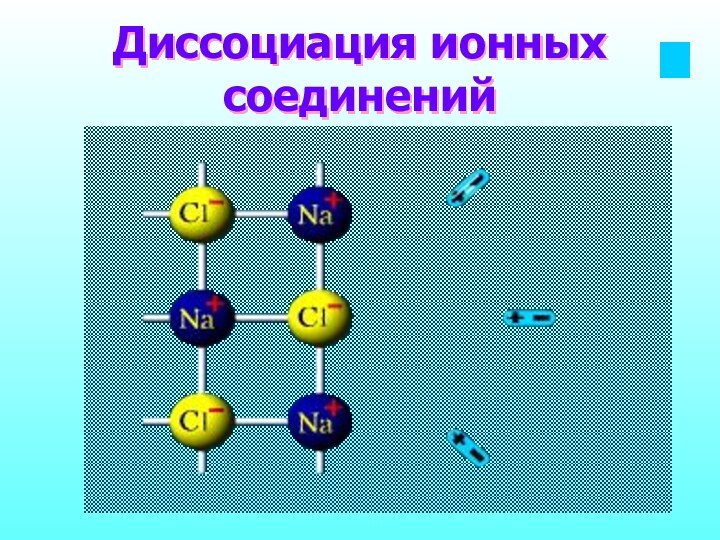
- 11. Диссоциация ионных соединений
- 12. В раствор переходят гидратированные ионы
- 13. Диссоциация соединений с КП связью
- 14. Образование в результате распада электролитов гидратированных ионов
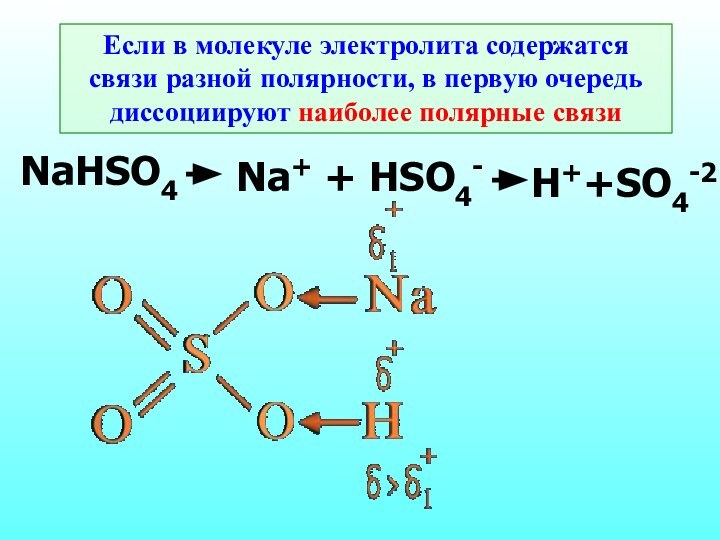
- 15. Если в молекуле электролита содержатся связи разной
- 16. Количественная характеристика процесса диссоциацииОтношение числа распавшихся молекул к общему числу молекул в раствореСила электролита
- 18. неэлектролитсильный электролитслабый электролит
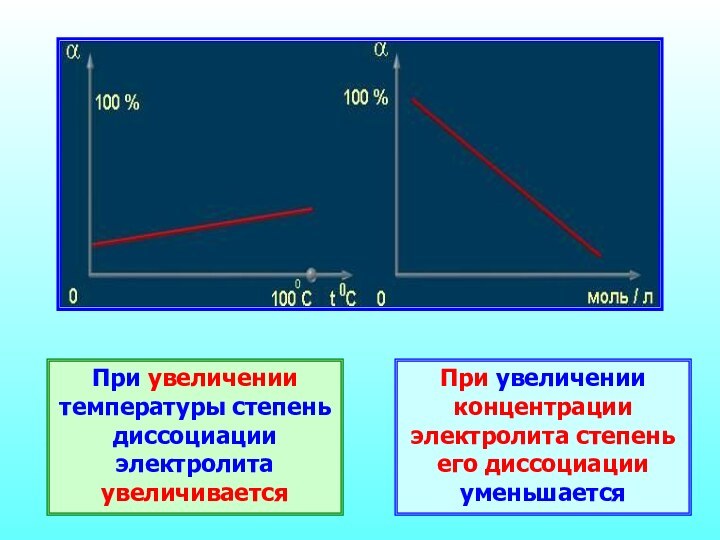
- 22. При увеличении температуры степень диссоциации электролита увеличиваетсяПри увеличении концентрации электролита степень его диссоциации уменьшается
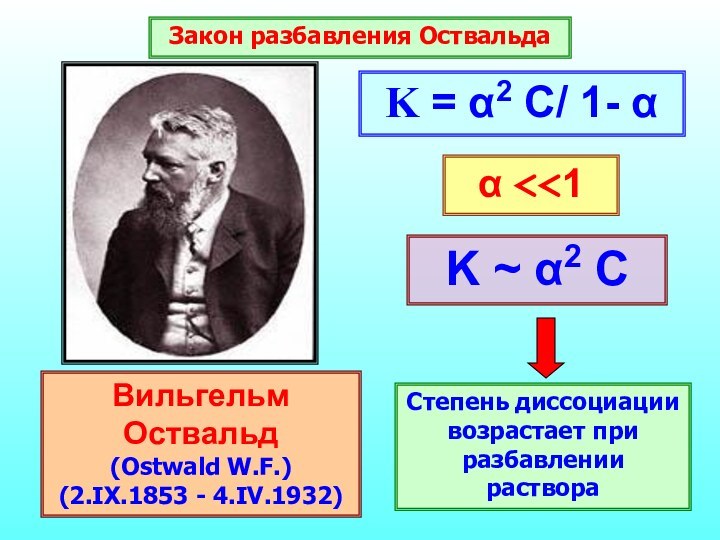
- 23. Константа диссоциацииХарактеризует способность слабого электролита распадаться на ионы
- 24. Скачать презентацию
- 25. Похожие презентации
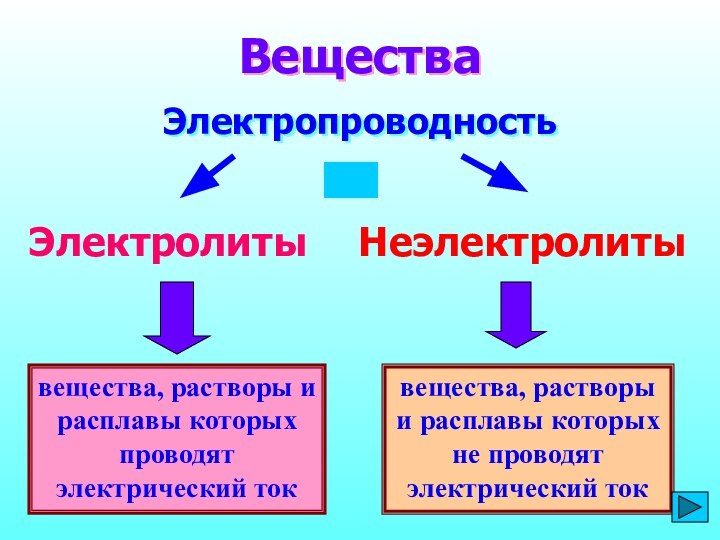
вещества, растворы и расплавы которых проводят электрический ток Вещества ЭлектропроводностьЭлектролитыНеэлектролитывещества, растворы и расплавы которых не проводят электрический ток


















Слайд 4
Ионная или сильнополярная ковалентная связь
Основания
Кислоты
Соли
Ковалентная неполярная или малополярная
связь
Органические соединения
Газы
Неметаллы
Электролиты
Неэлектролиты
Слайд 5
Теория электролитической диссоциации
С. А. Аррениус (1859-1927)
процесс растворения электролитов
сопровождается образованием заряженных частиц, способных проводить электрический ток
Процесс растворения
или плавления электролитов сопровождается образованием заряженных частиц , способных проводить электрический токСлайд 6 1. Электролиты при растворении в воде распадаются на
положительные и отрицательно заряженные ионы – электролитическая диссоциация.
2. Под
действием электрического тока положительно заряженные ионы движутся к отрицательному полюсу – катоду (катионы), отрицательно заряженные ионы к положительному полюсу - аноду (анионы).
3. Диссоциация - обратимый процесс. Наряду с распадом молекул на ионы может протекать процесс соединения ионов в молекулы (ассоциация)
Слайд 9
Причины распада вещества на ионы в расплавах
Нагревание
усиливает колебания ионов в узлах кристаллической решётки -кристаллическая решётка
разрушается.
Слайд 10
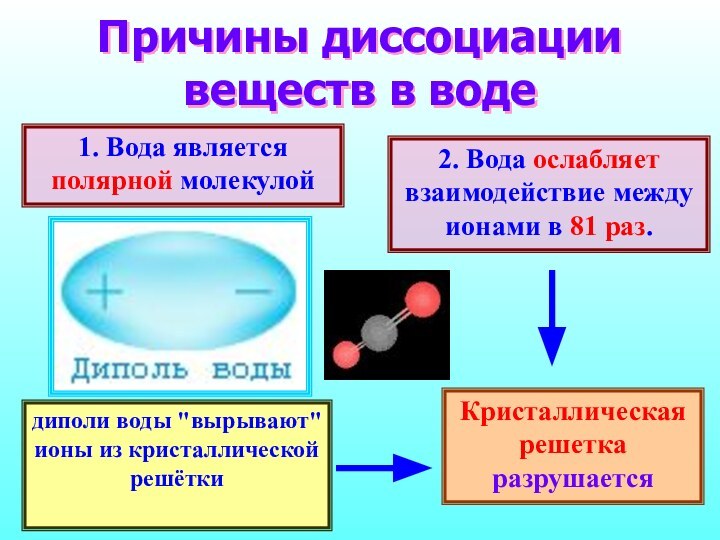
Причины диссоциации веществ в воде
1. Вода является
полярной молекулой
2. Вода ослабляет взаимодействие между ионами в
81 раз. диполи воды "вырывают" ионы из кристаллической решётки
Кристаллическая решетка разрушается