Слайд 2
Цели урока.
Познакомить учащихся с составом, названиями, классификацией и
представителями класса кислот.
Продолжить знакомство со сложными ионами на примере
кислотных остатков кислородных кислот.
Продолжить формирование знаний о различиях между зарядами ионов и с.о. элементов, об индикаторах.
Слайд 3
Актуализация опорных ЗУНов.
Что называется основаниями?
Какие реакции называются качественными?
Как
изменяют окраску индикаторы в щелочной среде?
Работа по группам:
1 группа – проверочная робота по теме «Основания».
2 группа – по учебнику выполнить упр 4, 6 стр. 70.
Слайд 4
Развитие новых ЗУНов
Попробуйте кристаллики лимонной кислоты
на вкус.
Он кислый, отсюда и название класса (кислоты).
Но ни один химик и не один грамотный человек даже и не подумает распознавать таким образом кислоты –это может быть смертельно опасно!
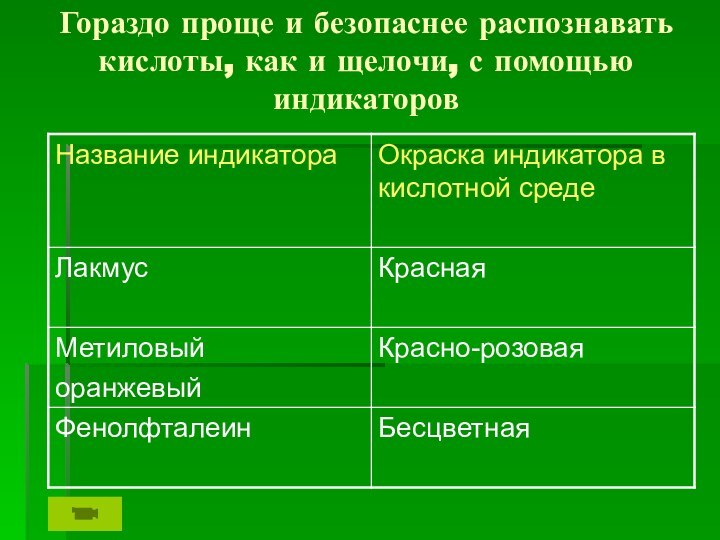
Слайд 5
Гораздо проще и безопаснее распознавать кислоты, как и
щелочи, с помощью индикаторов
Слайд 6
Кислоты
HCL – хлороводородная (соляная)
HNO3 - азотная
HNO2 - азотистая
H2SO4
- серная
H2SO3 - сернистая
H2S - сероводородная
H3PO4 - фосфорная
H2CO3 -
угольная
H2SiO3 - кремниевая
HBr - бромоводородная
HI - иодоводородная
HF – фтороводородная (плавиковая)
Слайд 7
Кислоты – это сложные вещества, молекулы которых состоят
из атомов водорода и кислотных остатков
Слайд 8
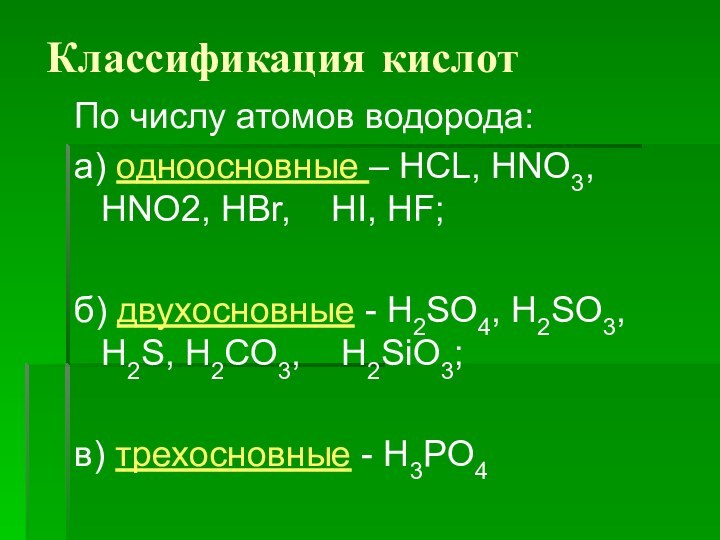
Классификация кислот
По числу атомов водорода:
а) одноосновные – HCL,
HNO3, HNO2, HBr, HI, HF;
б) двухосновные - H2SO4,
H2SO3, H2S, Н2CO3, H2SiO3;
в) трехосновные - H3PO4
Слайд 9
По наличию атомов кислорода в кислотных остатках:
а)
кислородсодержащие - HNO3, HNO2, H2SO4, H2SO3, Н2CO3, H3PO4, H2SiO3;
б) бескислородные - HCL, HBr, H2S.
Слайд 10
По признаку растворимости:
а) растворимые - HNO3, HNO2,
H2SO4, H2SO3, Н2CO3, H3PO4, HCL, HBr, H2S;
б) нерастворимые
- H2SiO3.
Слайд 11
Степени окисления элементов и заряды ионов кислот
Кислоты это
своеобразный мостик, который связывает полярную ковалентную связь с ионной.
В
растворах между водородом и кислотным остатком ковалентная связь переходит в ионную.
Кислоты образуют ионы двух видов: простые – ионы водорода Н+ и сложные – ионы кислотного остатка (SO42-, NO3-, PO43-)
Слайд 12
Отличия между степенью окисления и зарядом иона.
Число видов степени окисления элементов в соединениях
равно числу элементов в составе вещества, число видов ионов равно числу частей вещества. Так, для H2SO4:
а) заряды ионов H2+SO42-;
б) с.о. элементов H2+1S+6O42-.
Слайд 13
Представители кислот.
Техника безопасности при работе с кислотами.
HCL –
хлороводородная (соляная)
HNO3 – азотная
H2SO4 - серная
Слайд 14
Развитие новых ЗУНов.
Определите для кислоты: а) заряды ионов;
б) с.о. элементов; в) соответствующий ей оксид.
2. Какое количество
вещества содержится в