- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Электролитическая диссоциация
Содержание
- 2. Электролитическая диссоциация
- 3. Студент должен:Знать:положения теории электролитической диссоциации электролитов и
- 4. Электролитическая диссоциация- распад вещества на ионы в
- 5. По величине степени диссоциации электролиты делятся на
- 6. Диссоциация слабых электролитов- процесс обратимый и
- 7. Свойства химических соединений в растворах определяются характером
- 8. Al(OH)3 + 3NaOHрастворNa3[Al(OH )6];Sn(OH)2 +2HCl→SnCl2 + 2H2O;Sn(OH)2
- 9. Процесс ионизации воды протекает по уравнению: H2O H+
- 10. Кислотно-основные индикаторы- это вещества, меняющие окраску при
- 11. Пример 1. Составьте молекулярное уравнение реакций, если
- 12. б) ZnS↓+ 2Н+ →Zn2+ + H2S. Кислота - сильный
- 13. Пример 2. Вычислите рН 0,1 М
- 14. Пример 3. Вычислите рН 0,01 М
- 15. 1.Запишите уравнение реакций в ионном (полном и
- 16. 2. Можно ли приготовить растворы, содержащие одновременно следующие
- 17. 4. Составьте молекулярное уравнение реакций, если сокращенное
- 18. 6.Вычислите концентрацию ионов водорода в 0,01
- 19. ИОННЫЕ ПРОЦЕССЫ
- 20. Реакции в растворах электролитов, при которых не
- 21. При выводе ионно-молекулярных уравнений необходимо придерживаться следующей
- 22. Образование комплексного иона: HgJ2 + 2KJ = K2[HJ4] HgJ2
- 23. в) Образование слабой кислоты: 2CH3COONa + H2SO2= 2CH3COOH
- 24. Абсолютно нерастворимых веществ нет. В насыщенном растворе
- 25. В таком случае, на основании закона
- 26. Из понятия ПР вытекает условие образования
- 27. Пример 1. Написать ионно-молекулярные уравнения реакций
- 28. В реакции (д) два слабых электролита,
- 29. Пример 2. Составьте молекулярные уравнения реакций,
- 30. Например: а) Na2SO3 + 2HCI =2NaCI +
- 31. ГИДРОЛИЗ СОЛЕЙ
- 32. Гидролиз солей- это обменные реакции ионов соли
- 33. Гидролиз- процесс обратимый, его равновесие сильно смещено
- 34. Примеры решения задач Пример 1. запишите уравнения реакций
- 35. б) Na2C2O4 +Н2О.
- 36. Так как ионы Na+ не принимают участия
- 37. Если опустить все рассуждения, уравнение реакции гидролиза
- 38. в) Fe(NO3)2 + H2O.
- 39. г) (NH4) 2CO3+H2O (NH4) 2CO3→ 2NH4+ +2CO3 –
- 40. (Так как в молекуле воды только
- 41. д) FeS + Н20. Так как FeS
- 42. Пример . Запишите уравнения реакций гидролиза
- 43. 2А13++ 2НОН ↔ 2А1OН2+ + 2Н+
- 44. В правой части полного ионного уравнения
- 45. Пример . Запишите уравнения реакций, которые
- 46. 1. Запишите уравнения реакций гидролиза следующих солей
- 47. 4. Запишите уравнения реакций, которые происходят
- 48. Скачать презентацию
- 49. Похожие презентации
Электролитическая диссоциация







![Электролитическая диссоциация Al(OH)3 + 3NaOHрастворNa3[Al(OH )6];Sn(OH)2 +2HCl→SnCl2 + 2H2O;Sn(OH)2 + 2NaOHсплавление Na2SnO2 + 2H2OSn(OH)2](/img/tmb/12/1183124/f52f45927cdb662acf3d177cd359c947-720x.jpg)













![Электролитическая диссоциация Образование комплексного иона: HgJ2 + 2KJ = K2[HJ4] HgJ2 + 2K+ +2J-=2K+ + [HgJ4]2- HgJ2+](/img/tmb/12/1183124/54900b983043de76fe8f655753fc3d7e-720x.jpg)
























Слайд 3
Студент должен:
Знать:
положения теории электролитической диссоциации электролитов и гидролиза
солей
реакцию среды
Слайд 4
Электролитическая диссоциация- распад вещества на ионы в растворах
полярных растворителей или в расплавах.
Если вещество при растворении не
подвергается диссоциации, то это неэлектролит. Если вещество в процессе расстворения распадается на ионы, то это электролит.В растворах некоторых электролитов диссоциирует лишь часть молекул (процесс диссоциации обратим). Количественной характеристикой электролитической диссоциации является степень диссоциации:
α= Nдис/Nобщ=Сдис/Собщ,
где N- число молекул;
С- концентрация электролита в растворе.
Слайд 5
По величине степени диссоциации электролиты делятся на две
группы:
1) если α > 0,3 (30%), то такие электролиты
называют сильными. К сильным электролитам относятся некоторые кислоты ( HCl , H2SO4,HNO3, HClO4, HBr, HI, HMnO4), щелочи (растворимые в воде основания щелочных и щелочноземельных металлов, такие как NaOH, KOH, Ca (OH)2, Ba (OH)2 и др.) и растворимые соли. В растворах сильные электролиты практически полностью распадаются на ионы (диссоциация сильных электролитов необратимая и одноступенчатая) : Al2(SO4)3→2Al3++3SO42-. Положительно заряженные ионы-катионы; отрицательно заряженные ионы-анионы;2) если степень диссоциации электролита α<3%, то электролиты называются слабыми. К слабым электролитам относятся молекулы воды, гидроксида аммония, слабых кислот и оснований.
Слайд 6
Диссоциация слабых электролитов- процесс обратимый и ступенчатый:
СН3СООНСН3СОО-+Н+, для него устанавливается состояние химического равновесия, которое характеризуется
константой равновесия- константой диссоциации.При составлении ионных уравнений реакций в виде ионов пишем сильные растворимые в воде электролиты; в виде молекул- осадки, газы, слабые электролиты, простые вещества.
Условия протекания реакций ионного обмена: реакции ионного обмена протекают в водных растворах до конца (равновесие смещено в право) в том случае, если в результате реакции выделяется газ, образуется осадок или молекулы слабого электролита.
Слайд 7 Свойства химических соединений в растворах определяются характером их
диссоциации:
HCl→H++Cl- (кислоты при диссоциации дают ионы H+);
NaOH→Na+
+OH- (основания при диссоциации дают ионы OH- )NaCl→ Na+ + Cl- ( соли при диссоциации дают катионы металлов и анионы кислотных остатков).
Существуют электролиты, которые могут участвовать в химических реакциях как в роли основания, так и в роли кислоты. Такие электролиты называются амфотерными. К ним относятся основания некоторых металлов: Zn(OH)2, Sn(OH)2, P(OH)2, Be(OH)2, Al(OH)3, Cr(OH)3 и некоторых других. Они способны реагировать как с кислотами, так и с основаниями, образуя в качестве продуктов реакций соли: Al(OH)3 + 3HCl→AlCl3 +3H2O;
Al(OH)3 + NaOH сплавление NaAlO2+ 2H2O;
Слайд 8
Al(OH)3 + 3NaOHрастворNa3[Al(OH )6];
Sn(OH)2 +2HCl→SnCl2 + 2H2O;
Sn(OH)2 +
2NaOHсплавление Na2SnO2 + 2H2O
Sn(OH)2 + 2NaOHраствор Na2[Sn (OH)4]
Слайд 9
Процесс ионизации воды протекает по уравнению:
H2O H+ +OH-
+55,9 кДж/моль.
В нейтральных растворах: СМ(H+ )= СМ(OH- )= 10-7
М (при 25 С)Ионное произведение воды: СМ(H+ )* СМ(OH- )= 10-14 =Кв.
Увеличение концентрации ионов H+ ведет к уменьшению концентрации ионов OH- так, что их произведение остается неизменным.
рН=-lg (СМ(H+ )) или рН= -lg [H+ ]
где lg- десятичный логарифм, показывает, в какую степень надо возвести 10, чтобы получить данное число.
Нейтральная среда: рН=7.
Кислая среда: рН<7.
Щелочная среда: рН>7.
Слайд 10
Кислотно-основные индикаторы- это вещества, меняющие окраску при изменении
рН раствора. Индикаторами могут быть слабые органические кислоты или
основания, молекулы и ионы которых имеют разную окраску.
Слайд 11 Пример 1. Составьте молекулярное уравнение реакций, если сокращенное
ионное уравнение записывается в виде:
а) Сl- + Ag+→ AgCl↓;
б) ZnS↓ + 2H+→ Zn2++H2S;в) А1(ОН)3+ ЗОН-→[АlОН)6]3-.
Решение. а) Сl -+ Ag+ → AgCl↓.
Если в сокращенном ионном уравнении присутствуют ионы, значит, этот ион входил в состав сильного растворимого в воде электролита (например, Cl- -в состав НСl; NaCl, но не РbСl2). Выбирая электролиты таким образом, можно составить одно из возможных молекулярных уравнений; например:
NaCl + AgNO3 → AgCl↓ + NaNO3
Выбранные нами молекулы должны образовывать только один осадок, вторая соль должна быть растворима в воде, так как ионов, образующих ее, нет в сокращенном ионном уравнении.
Слайд 12
б) ZnS↓+ 2Н+ →Zn2+ + H2S.
Кислота - сильный электролит,
должна образовывать с ионом цинка растворимую соль (например, ZnCl2):
ZnSi
+ 2HCl->ZnCl2+H2S.в)Аl(ОН)3↓ + ЗОН- →[Аl(ОН)6]3-.
Гидроксид алюминия - амфотерный электролит, растворяется в сильных щелочах: Аl(ОН)3 ↓ + ЗКОН → К3[Аl(ОН)6].
Слайд 13
Пример 2. Вычислите рН 0,1 М раствора
соляной кислоты (α = 100%).
Решение. Если α =
100%, то диссоциация электролита полная (в растворе он полностью распадается на ионы):НС1 → Н+ + Сl -
Концентрация ионов водорода равна исходной концентрации кислоты:
СH+ = См (НСl) = 0,1 М;
рН = - lg[H+] = - lg(10-1) = 1.
Слайд 14
Пример 3. Вычислите рН 0,01 М раствора
гидроксида натрия ( α= 100%).
Решение. NaOH → Na++ ОН-
СOH-
= CM (NaOH) = 0.001 моль/л; [H+][ОН-]= 10-14, [H+]=10-14 /10-3=10-11 (моль/л);
рН= 11.
Слайд 15 1.Запишите уравнение реакций в ионном (полном и сокращенном)
виде:
a)Cu(NO3)2+KOH→ ...; д) HN03 + Ва(ОН)2→..;
б) FeS04 + Na2S →...; е)
NH4NO3 + H2S04 →...;в) Na2C03 + HNO3 →...; ж) NaN02 + H3P04 →...;
г) MnS↓ + HCI → ...; з) Zn(OH)2 + NaOH →....
15`
Слайд 16
2. Можно ли приготовить растворы, содержащие одновременно следующие вещества:
а)Na2СO3
и НС1; г)
NH4NO3 и NaOH;б) AgNO3 и СuС12; д) MgCl2 и HNO3?
в) ZnCl2 и Ba(N03)2;
3. Можно ли приготовить растворы, содержащие одновременно следующие ионы:
а) Zn2+; А13+; Сl-; NO3-; г) Ba2+;Cu2+; NO3- ; Cl-;
б) Na+; Ag+; SO42-; NO3-; д) Ba2+; Na+; Сl-; OH-?
в) H+; K+; CO32-; SO42-;
Слайд 17
4. Составьте молекулярное уравнение реакций, если сокращенное ионное
уравнение записывается в виде:
а) Cu2+ + 2S3- →CuS;
б) Н+ + ОН-
→ Н20;в) Zn2+ + 4 ОН- → [Zn(OH)4]2-
5.Вычислите рН 0,0001 М раствора азотной кислоты (диссоциацию электролита считать полной).
Слайд 18
6.Вычислите концентрацию ионов водорода в 0,01 М
растворе гидроксида аммония NH4OH, если степень диссоциации составляет 0,2%.
7.Определите
концентрацию гидроксид-ионов в растворе с рН = 8.
Слайд 20
Реакции в растворах электролитов, при которых не происходит
изменение зарядов ионов, входящих в соединение, называются обменными реакциями.
Например: имеются два электролита КА и К1А1 (К и К1 – катионы, А и А1 – анионы), между которыми в растворе устанавливается равновесие:КА+К1А1 ↔ КА1+ К1А
Известно, что равновесие в ионно-обменных реакциях в растворах смещается в сторону образования наименее диссоциированных соединений. Направление реакций ионного обмена между двумя электролитами в растворе определяется возможностью образования между их ионами малорастворимого, малодиссоциированого, а также газообразного соединения.
Слайд 21
При выводе ионно-молекулярных уравнений необходимо придерживаться следующей формы
записи:
а) сильные электролиты следует писать в виде отдельных составляющих
их ионов, либо именно в таком состоянии они находятся в растворе;б) слабые электролиты, газы, а также малорастворимые соединения следует условно писать в виде молекул, независимо от того, являются они исходными веществами или продуктами. Например:
Реакция, идущая с образованием осадка:
АgNО3+ NaCI = AgCI↓ + NaNO3– молекулярное уравнение
Аg ++ CI-=AgCI↓ – ионное уравнение
Слайд 22
Образование комплексного иона:
HgJ2 + 2KJ = K2[HJ4]
HgJ2 +
2K+ +2J-=2K+ + [HgJ4]2-
HgJ2+ 2J-= [HgJ4]2-
Образование слабых электролитов:
а) образование
водыNaOH + HCI = H2O + НСI
OH-+H+ = H2O;
б) Образование слабого основания:
NH4CI + NaOH = NaCI + NH4OH
NH4+ +OH- =NH4OH;
Слайд 23
в) Образование слабой кислоты:
2CH3COONa + H2SO2= 2CH3COOH +
Na 2SO4
2CH3COO- + 2H+ =2CH3COOH
г) Образование газов:
Na2S +2HCI =
2NaCI+ H2S↑S2- + 2H+ = H2S↑
Слайд 24 Абсолютно нерастворимых веществ нет. В насыщенном растворе малорастворимого
электролита, например BaSO4, находящегося в соприкосновении с твердой фазой,
непрерывно протекают два противоположных процесса. В состоянии равновесия, когда оба процесса протекают с одинаковой скоростью, образовавшаяся гетерогенная система определяется выражением:растворение
BaSO4 Ba2+ +SO42-
осадок кристаллизация
Переход ионов в раствор и обратный процесс внедрения ионов в кристаллическую структуру твердого вещества происходят лишь на его поверхности.
Слайд 25
В таком случае, на основании закона действия
масс, состояние равновесия зависит только от произведения концентрации ионов,
которое для данного малорастворимого электролита является величиной постоянной.Произведение концентрации ионов в насыщенном растворе малорастворимого электролита представляет собой величину постоянную при данной температуре и называется произведением растворимости (ПР). Для сульфата бария эта величина определяется выражением:
К = [Ва2+]∙[SO42-] = ПР ВaSO4
и составляет 1,1∙ 10-10 при 250С. Чем больше величина ПР, тем больше растворимость.
Слайд 26
Из понятия ПР вытекает условие образования осадков:
труднорастворимый электролит выпадает в осадок, когда произведение концентраций его
ионов в растворе становится больше величины ПР. Это будет достигнуто прибавлением избытка электролита, содержащего одноимённые ионы.Растворение осадка будет происходить тогда, когда произведение концентрации его ионов в растворе станет меньше величины ПР. Этого можно добиться, связывая один из ионов, посылаемых осадком в раствор.
Слайд 27
Пример 1. Написать ионно-молекулярные уравнения реакций взаимодействия
между водными растворами следующих веществ: a) HCI и NaOH; б)
Pb(NO3)2 и Na2S;в) NaСIO и HNO3; г) К2СО3 и H2SO4; д) СН3СООН и NaOH.Решение. Запишем уравнения взаимодействия указанных веществ в молекулярном виде:
а)HCI+NaOH=NaCI+Н2О
б) Pb(NO3)2 + Na2S= PbS+2NaNO3
в)NaCIO + HNO3 = NaNO3 + HCIO
г)K2CO3 + H2SO4 = K2SO4 + CO2 + H2O
д)CH3COOH + NaOH = CH3COONa + H2O
Отметим, что взаимодействие этих веществ возможно, ибо в результате происходит связывание ионов с образованием слабых электролитов (Н2О, НIO) , осадка (РЬS), газа (СО2).
Слайд 28
В реакции (д) два слабых электролита, но
так как. реакции идут в сторону большего связывания ионов
и вода – более слабый электролит, чем уксусная кислота, то равновесие реакции смещено в сторону образования воды. Исключив одинаковые ионы из обеих частей равенства a) Na+ и СI‾ б) Na+ и NO‾3; в) Na+ и NO‾3; г) К+ и SO2-4; д) Na+, получим ионно-молекулярные уравнения соответствующих реакций:а) Н++ОН¯ = Н2О
б) Pb2+ + S2¯ = PbS
в) СIO¯+ Н+ = НСIO
г) СО32¯ +2Н+ = СО2 + Н2О
д) СН3СООН + ОН¯= СН3СОО¯ + Н2О
Слайд 29
Пример 2. Составьте молекулярные уравнения реакций, которым
соответствуют следующие ионно-молекулярные уравнения:
a) SО32¯ +2Н+ = SО2 +
Н2Об) РЬ2+ + CrO2-4= PbCrO4
в) НСО-3 + ОН-= СО32- + Н2О
г) ZnОН++Н+ = Zn2+ + Н2О
Решение. В левой части данных ионно-молекулярных уравнений указаны свободные ионы, которые образуются при диссоциации растворимых сильных электролитов, следовательно, при составлении молекулярных уравнений следует исходить из соответствующих растворимых сильных электролитов.
Слайд 30
Например:
а) Na2SO3 + 2HCI =2NaCI + SO2
+ Н2О
б)Pb(NO3)2+K2CrO4=PbCrO4+2KNO3
в) КНСО3 + КОН = К2СО3 + Н2О
г)
ZnOHCI + HCI=ZnCI2 +H2O
Слайд 32
Гидролиз солей- это обменные реакции ионов соли и
молекул воды, приводящие к образованию ионов или молекул слабых
электролитов.Гидролизу подвергаются ионы- остатки слабых кислот и слабых оснований
В процессе гидролиза изменяются концентрации ионов Н+ и ОН+ в растворе (рН среды).
Гидролиз- процесс ступенчатый, в обычных условиях протекает только по первой ступени.
На каждой ступени гидролиза на один ион соли, участвующий в процессе, приходится одна молекула воды.
Слайд 33
Гидролиз- процесс обратимый, его равновесие сильно смещено влево,
в сторону исходных веществ.
Равновесие реакции гидролиза подчиняется принципу Ле
Шателье (смещение химического равновесия).Гидролиз усиливается при нагревании и разбавлении раствора соли.
Нерастворимые в воде соли гидролизу практически не подвергаются.
Гидролиз солей, которые полностью разлагаются водой (в таблице растворимости для такой соли стоит прочерк), идет необратимо и до конца.
Слайд 34
Примеры решения задач
Пример 1. запишите уравнения реакций гидролиза
следующих солей и определите реакцию среды (нейтральная, кислая, щелочная):
а)
NaNO3; б) Na2C2O4; Fe(NO3) 2 ;г) (NH 4) 2CO3 ; FeS; е)Fe2S3.Решение.
а) NaNO3+Н2О.
Запишем уравнение диссоциации соли и определим силу кислоты и основания, образующих данную соль:
NaNO3→Na++NO3-
NaOH HNO3
сильное сильная
основание кислота
В составе соли нет ионов-остатков слабых кислот или слабых оснований.
Гидролиз такой соли не идет, реакция среды не изменяется NaNO3+Н2О≠.
Среда нейтральная, рН=7.
Слайд 35
б) Na2C2O4 +Н2О.
Na2C2O4→2Na++C2O42-
NaOH H2C2O4
сильное слабая
основание кислота
В гидролизе участвует анион слабой кислоты, который реагирует с одной молекулой, присоединяя один ион водорода.
+ -
C2O42- +Н ОН ⇄Н C2O4- +ОН-
(уравнение реакции гидролиза в сокращенной ионной форме)
(Нельзя писать C2O42- +2НОН ⇄Н C2O4- +2ОН-, так как на каждой ступени гидролиза участвует только одна молекула воды.)
Слайд 36
Так как ионы Na+ не принимают участия в
гидролизе, то они присутствуют в неизменной форме в левой
и правой частях уравнения:+ -
2 Na+ +C2O42- +Н ОН ⇄Н C2O4- +ОН-+2 Na+
(полное ионное уравнение реакции гидролиза)
Для того чтобы записать уравнение реакции гидролиза в молекулярной форме, объединим ионы в молекулы в соответствии с их зарядами:
Na2C2O4 +НОН ⇄ NaНC2O4+NaОН
(уравнение гидролиза в молекулярной форме)
Из сокращенного ионного уравнения гидролиза видно, что в растворе накапливаются ионы ОН-, т.е. среда щелочная, рН>7.
Слайд 37
Если опустить все рассуждения, уравнение реакции гидролиза Na2C2O4
можно записать следующим образом:
Na2C2O4 +НОН ⇄;
C2O42- -ион слабой
кислоты, гидролиз по аниону;C2O42- +Н ОН ⇄Н C2O4- +ОН- (щелочная среда, рН>7);
2 Na+ +C2O42- +Н ОН ⇄Н C2O4- +ОН-+2 Na+ ;
Na2C2O4 +НОН ⇄ NaНC2O4+NaОН ;
Слайд 38
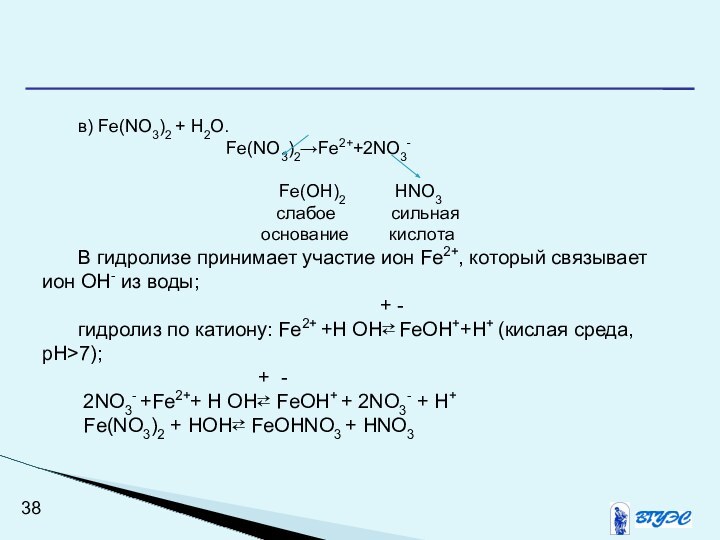
в) Fe(NO3)2 + H2O.
Fe(NO3)2→Fe2++2NO3-
Fe(OH)2 HNO3
слабое сильная
основание кислота
В гидролизе принимает участие ион Fe2+, который связывает ион ОН- из воды;
+ -
гидролиз по катиону: Fe2+ +Н ОН⇄ FeOH++Н+ (кислая среда, рН>7);
+ -
2NO3- +Fe2++ Н ОН⇄ FeOH+ + 2NO3- + Н+
Fe(NO3)2 + НОН⇄ FeОНNO3 + HNO3
Слайд 39
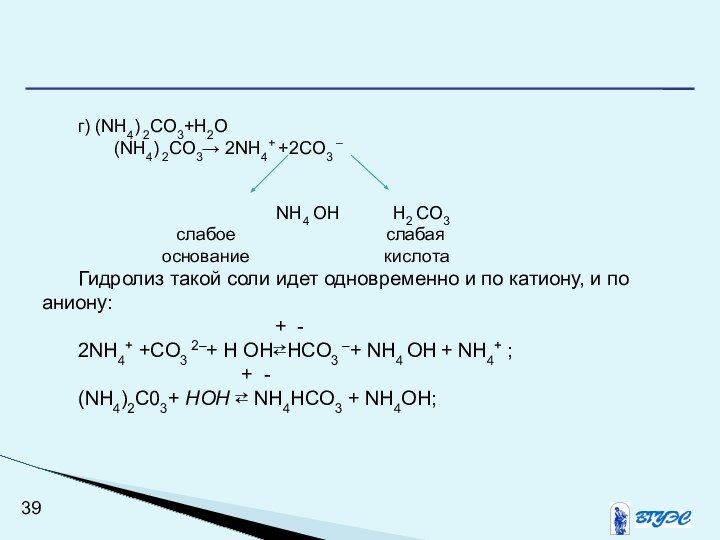
г) (NH4) 2CO3+H2O
(NH4) 2CO3→ 2NH4+ +2CO3 –
NH4 OH H2 CO3
слабое слабая
основание кислота
Гидролиз такой соли идет одновременно и по катиону, и по аниону:
+ -
2NH4+ +CO3 2–+ Н ОН⇄НCO3 –+ NH4 OH + NH4+ ;
+ -
(NH4)2C03+ НОН ⇄ NH4HCO3 + NH4OH;
Слайд 40
(Так как в молекуле воды только один
ион ОН-, то на первой ступени гидролиза связывается только
один ион NH4+)В данном случае полное ионное уравнение совпадает с сокращенным ионным уравнением.
Так как в процессе гидролиза (NH4)2CO3 не образуется свободных ионов Н+ и ОН-, а только молекулы или ионы слабых кислот и оснований (в данном случае - NH4OH и НСОз-), то реакция среды близка к нейтральной и определяется более точно силой образовавшихся кислоты и основания.
Слайд 41
д) FeS + Н20.
Так как FeS в
воде нерастворима, гидролиз ее не идет.
FeS + Н20 ≠
.e)Fe2S3 + H20.
В таблице растворимости для соли Fe2S3 стоит прочерк, это значит, что гидролиз соли идет необратимо и до конца, до образования соответствующих основания и кислоты:
Fe2S3 + 6Н20 = 2Fe(OH)3↓ + 3H2S↑.
(соль полностью разлагается водой)
Слайд 42
Пример . Запишите уравнения реакций гидролиза следующих
солей: a) A12(S04)3; б) CuSO4
Решение. a)Al2(S04)3+H20.
Al2(SO4)3→ 2Al3++2S042-
Al(OH)3 H2SO4слабое сильная
основание кислота
Гидролиз соли идет по катиону: Аl3++ НОН ↔ АlOН2++ Н+
Так как в состав молекулы сульфата алюминия входят два иона Аl , а сокращенное ионное уравнение записано для одного иона, то при составлении полного ионного уравнения сокращенное ионное уравнение надо удвоить (умножить на 2).
Слайд 43
2А13++ 2НОН ↔ 2А1OН2+ + 2Н+ (
сокращенное ионное уравнение);
3S042-+2A13++2H0H ↔2Al0H2++2H++3SO42- (полное ионное уравнение);
Al2(SO4)3+2Н20
↔ 2A10HS04 +H2S04 (молекулярное уравнение).6)CuS04+H20.
CuS04 →Cu2++S042-
Си(ОН)2 H2SO4
слабое сильная
основание кислота
Гидролиз по катиону:
Си 2++ НОН ↔ СuОН++ Н+ (сокращенное ионное уравнение);
S042-+Cu2+ +HOH ↔ CuOH+ +Н+ + S042-(полное ионное уравнение).
Слайд 44
В правой части полного ионного уравнения присутствуют
2 катиона (СиОН+ и Н+) и только один анион
(S04 2-). Объединить их в одну молекулу невозможно, так как в состав одной молекулы не могут входить одновременно ионы Н+ и ОН- . Для того чтобы составить молекулярное уравнение гидролиза сульфата меди, удвоим полное ионное уравнение (это не противоречит утверждению о том, что на один ион, участвующий в гидролизе, приходится только одна молекула воды):2S042-+ 2Cu2++ 2НОН ↔ 2CuOH ++ 2Н++ 2S042-;
2CuS04+2HOH↔ (CuOH)2S04+H2S04 (молекулярное уравнение).
Слайд 45
Пример . Запишите уравнения реакций, которые происходят
при смешивании водных растворов Na2S и АlСl3.
Решение. При смешивании
водных растворов сульфида натрия и хлорида алюминия идет реакция обмена:3Na2S + 2АlСl3 = Al2S3 + 6NaCl.
Как указано в таблице растворимости, образовавшийся сульфид алюминия не существует в водных растворах (подвергается полному и необратимому гидролизу):
Al2S3 + 6Н20 = 2Аl(ОН)3↓+ 3H2S↑
Так как оба процесса идут одновременно, можно записать суммарное уравнение реакции:
3Na2S + 2 AlCl3 + 6Н2O = 2Al(OH)3↓ + 3H2S↑ + 6NaCl
(взаимный гидролиз)
Слайд 46 1. Запишите уравнения реакций гидролиза следующих солей и
определите реакцию среды:
NaNO3; б) NH4CI; в) K2SO4; г) СuСl2;
д) CuS; e) А12(СO3)3 ж) K2S; з) CH4COONH4; и) Na2S; к) (NH4)2S.2. Запишите уравнения реакций гидролиза следующих солей:
a) FeSO4; б) Cr2(SO4)3; в) CaS; г) Fe2(SO4)3 (первую и вторую ступени гидролиза).
3. Какие вещества можно добавить к водным растворам солей, чтобы уменьшить их гидролиз: a) FeCl3, б) Na2CO3?