Слайд 2
Структура работы
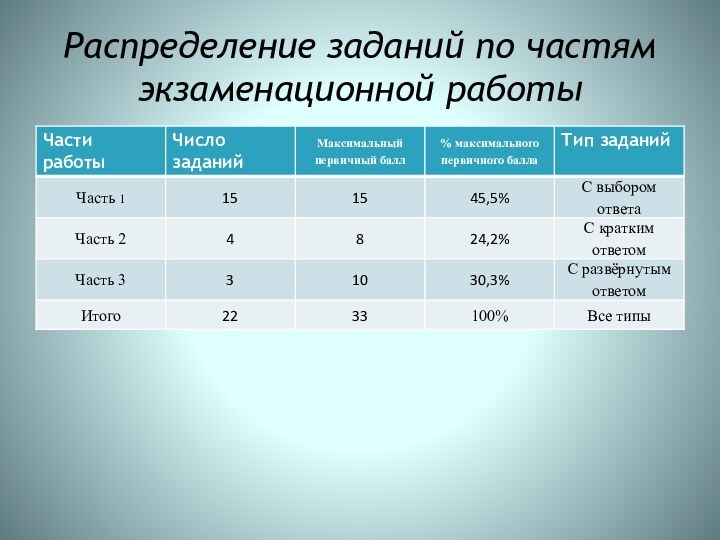
Часть 1 содержит 15 заданий с выбором
ответа. Их обозначение в работе: А1; А2; А3; А4
… А15.
Часть 2 содержит 4 задания с кратким ответом. Их обозначение в работе: В1; В2; В3, В4.
Часть 3 содержит 3 задания с развёрнутым ответом. Их обозначение в работе: С1, С2, С3.
Слайд 3
Распределение заданий по частям экзаменационной работы
Слайд 4
Распределение заданий по уровню сложности
Слайд 5
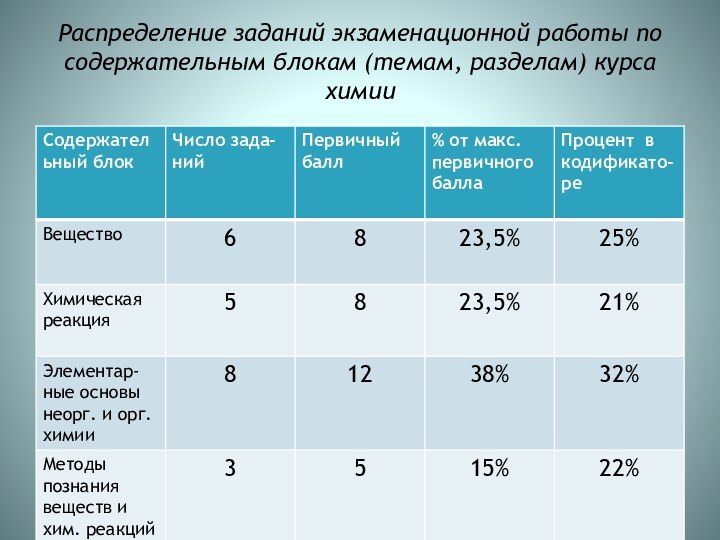
Распределение заданий экзаменационной работы по содержательным блокам (темам,
разделам) курса химии
Слайд 6
Шкала пересчета первичного балла
Слайд 7
Задания блока А
Задания с выбором ответа проверяют на
базовом уровне усвоение значительного количества элементов содержания (23 из
28) из всех четырёх содержательных блоков курса:
знание языка науки,
основных химических понятий,
общих свойств классов неорганических и органических соединений, металлов, неметаллов;
признаков классификации элементов, неорганических и органических веществ, химических реакций; знания о видах химических связей и др.
Слайд 8
А1. Строение атома
Распределение электронов по энергетическим уровням в
атоме хлора соответствует ряду чисел
1) 7,8,2
2) 2,8,7
3) 2,7
4)
2,8,8,7
Слайд 9
А2. ПЗ и ПС
Наиболее выражены неметаллические свойства у
элемента 3 периода
1) IIIА группы
2) VА группы
3)
IVА группы
4) VIА группы
Слайд 10
А3. Строение молекул. Химическая связь
Химическая связь в оксиде
калия
1) металлическая
2) ионная
3) ковалентная полярная
4) ковалентная неполярная
Слайд 11
А4. Валентность и степень окисления
Валентность серы в соединениях
SO3 и SO2 соответственно равна
1) III и II
2)
VI и IV
3) VI и II
4) III и IV
Слайд 12
А5. Простые и сложные вещества. Классификация
Кислотным оксидом является
1) оксид углерода(II)
2) оксид азота(I)
3) оксид азота(V)
4) оксид азота(II)
Слайд 13
А6. Классификация химических реакций. Условия протекания реакций
Взаимодействие железа
с раствором серной кислоты относят к реакциям
1) обмена
2)
соединения
3) замещения
4) разложения
Слайд 14
А7. Электролиты и неэлектролиты
Наибольшее количество катионов образуется при
полной диссоциации 1 моль
1) фосфата натрия
2) нитрата алюминия
3)
хлорида железа(III)
4) сульфата железа(III)
Слайд 15
А8. Реакции ионного обмена
Сокращённое ионное уравнение
Zn2+
+ 2 OH– = Zn(OH)2
соответствует взаимодействию
1)оксида цинка и
воды
2)хлорида цинка и воды
3)хлорида цинка и гидроксида натрия
4)нитрата цинка и гидроксида железа (II)
Слайд 16
А9. Химические свойства простых веществ
При комнатной температуре реагируют
1) сера и кислород
2) азот и кислород
3) барий и
вода
4) цинк и вода
Слайд 17
А10. Химические свойства оксидов
Оксид алюминия реагирует с
1)
O2
2) NaOH
3) K3PO4
4) MgSO4
Слайд 18
А11. Химические свойства гидроксидов
Гидроксид натрия реагирует с каждым
из двух веществ:
1) фосфорная кислота и вода
2) нитрат меди
(II) и оксид алюминия
3) хлорид железа (II) и сульфат калия
4) оксид кальция и соляная кислота
Слайд 19
А12. Химические свойства солей
Раствор хлорида меди(II) реагирует с
каждым из двух веществ
1) Ва(NO3)2, KOH
2) Fe, AgNO3
3)
SO2, Na3PO4
4) Al(OH)3 , Al
Слайд 20
А13. Вещества и смеси. ТБ
Верны ли следующие суждения
о чистых веществах и смесях:
А. Молоко – это чистое
вещество.
Б. При растворении мела в воде образуется неоднородная смесь.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
Слайд 21
А14. Определение характера среды. Качественные реакции
Ион NH4+ можно
обнаружить в растворе с помощью
1) хлорида калия
2) гидроксида
калия
3) нитрата бария
4) сульфата калия
Слайд 22
А15. Массовая доля элемента
Массовая доля кислорода в
нитрате магния равна
1) 55,8 %
2) 32,4 %
3)
10,8 %
4) 64,7%