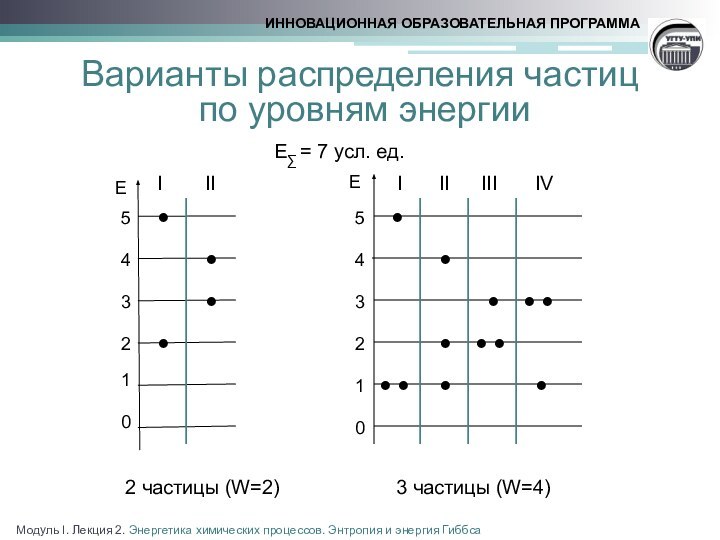
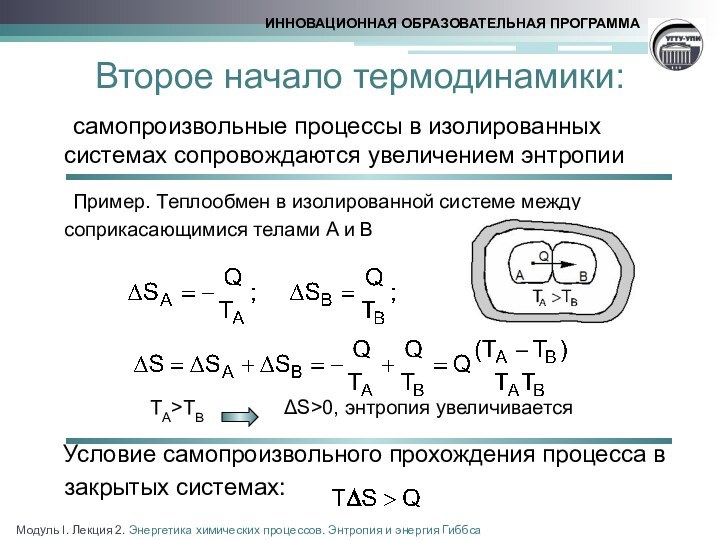
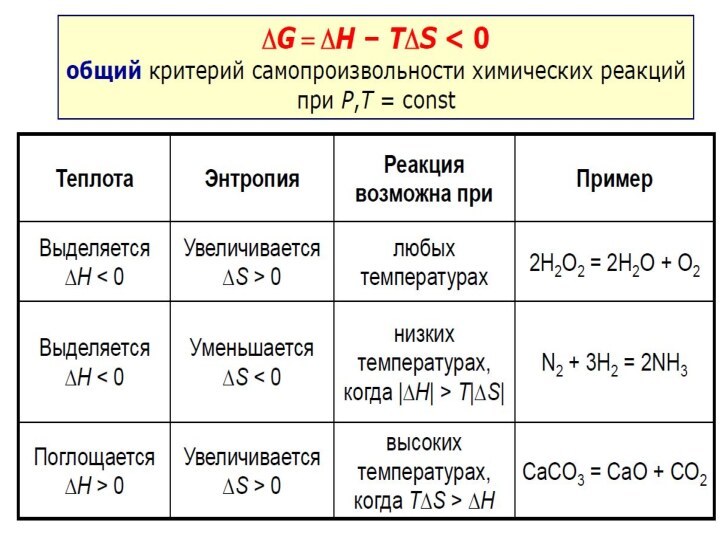
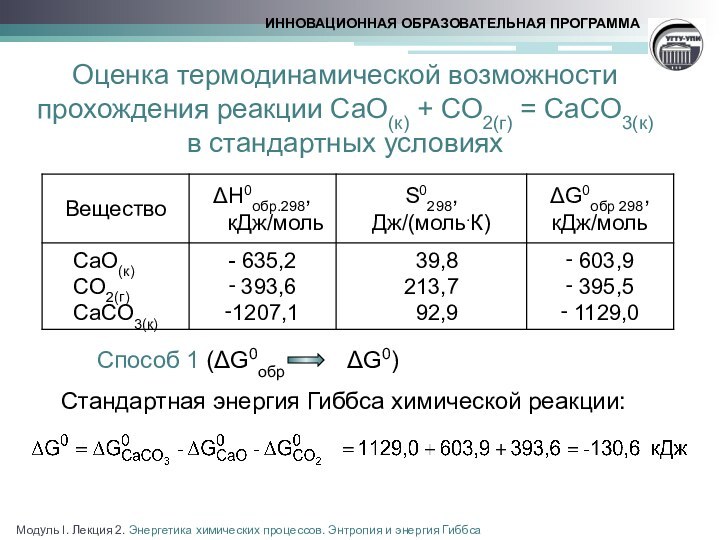
реакции
Влияние температуры на направление химической реакции
Расчет стандартной энергии Гиббса
химической реакцииМодуль I. Лекция 2. Энергетика химических процессов. Энтропия и энергия Гиббса