- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему по химии Строение атома (8 класс)
Содержание
- 2. Ничто не происходит без достаточного основания М.ЛОМОНОСОВ
- 3. Наиболее значимые открытия в истории открытия строения
- 4. В 1911 г. Э.Резерфорд совместно с своими ассистентами
- 5. Альфа-частицы (α-частица тяжелее электрона в 7350 раз, имеет
- 6. Альфа-частицы, проходя через фольгу, проходят «сквозь» атомы
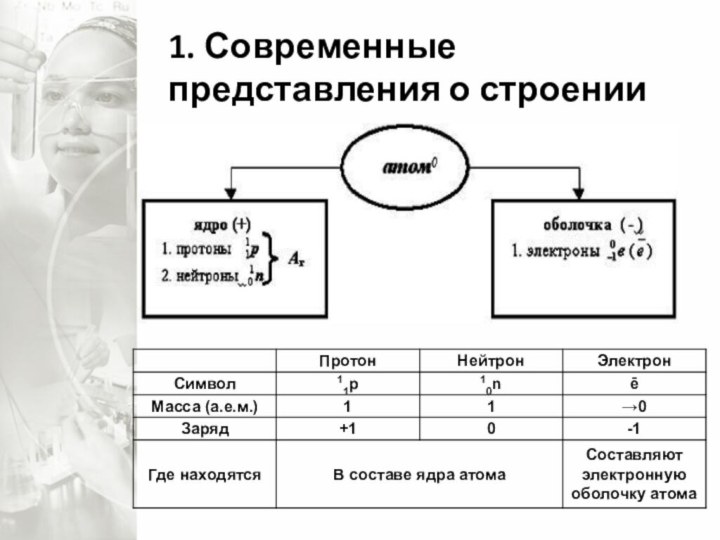
- 7. 1. Современные представления о строении атома
- 8. Обладая информацией о построении Периодической системы химических
- 9. При изменении электронных оболочек атомы превращаются в
- 10. Проверь себя! Ответь на вопросы! Если затрудняешься,
- 11. 2. Строение электронных оболочек атомовИсследования Нильса Бора –
- 12. Строение электронных оболочек атомов играет важную роль
- 13. Электроны, обладающие близкими значениями энергии, образуют единый
- 14. Электрон движется не по орбите, а по
- 15. Электроны разных подуровней одного и того же
- 16. Энергетические уровни заполняются электронами последовательно.Эта последовательность определена
- 17. Алгоритм составления электронных формул атомовОпределяем общее число
- 18. Примеры.1. Ядро атома водорода имеет заряд +1,
- 19. Электронно-графические или квантово-механические формулы.Ученые условились обозначать каждую
- 20. Ядро атома водорода имеет заряд +1, поэтому
- 21. Принципы заполнения электронных орбиталей атомов: Принцип Паули: на
- 22. Проверь себя! Ответь на предложенные вопросы. При
- 23. Задания для самопроверки Ответы: Слайд 25 Электронная конфигурация
- 25. Скачать презентацию
- 26. Похожие презентации



















Слайд 2
Ничто не происходит без достаточного основания
М.ЛОМОНОСОВ
Цель
урока:
котором строятся все дальнейшие теории и понятия.
Слайд 3
Наиболее значимые открытия в истории открытия строения атома:
1895
г – немецкий ученый Уильям Конрад Рентген обнаружил новый
вид излучения.1896 год – французский ученый Анри Беккерель открыл явление естественной радиоактивности.
1897 год – Джон Томпсон провел опыты с катодными лучами, установил массу и заряд частиц, составляющих электричество.
1900 год – немецкий ученый Планк сделал доклад об открытии закона излучения.
1911 год – английский ученый Эрнест Резерфорд провел опыт и сделал выводы о планетарной модели атома.
Слайд 4 В 1911 г. Э.Резерфорд совместно с своими ассистентами Г.Гейгером
и Э.Марсденом провел эксперимент, который внёс решающий вклад в
создание современной теории строения атома.Я был поражён простотой аппаратуры, которую вы используете, и блестящими результатами, которые вы получаете. Мне представляется гением тот, кто может работать со столь примитивным оборудованием и собирать богатую жатву, далеко превосходящую то, что бывало добыто с помощью самых тонких и сложных приборов.
Х.Нагаока. Из письма Э.Резерфорду. 1911 г.
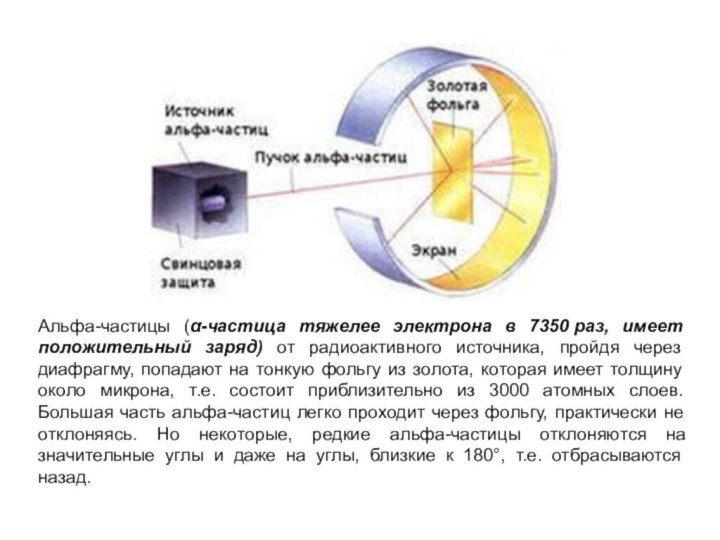
Слайд 5 Альфа-частицы (α-частица тяжелее электрона в 7350 раз, имеет положительный
заряд) от радиоактивного источника, пройдя через диафрагму, попадают на
тонкую фольгу из золота, которая имеет толщину около микрона, т.е. состоит приблизительно из 3000 атомных слоев. Большая часть альфа-частиц легко проходит через фольгу, практически не отклоняясь. Но некоторые, редкие альфа-частицы отклоняются на значительные углы и даже на углы, близкие к 180°, т.е. отбрасываются назад.Слайд 6 Альфа-частицы, проходя через фольгу, проходят «сквозь» атомы золота.
Это возможно потому, что легкие электроны почти не влияют
на движение тяжелой альфа-частицы.Так как α-частицы в большинстве случаев отклоняются на малые углы, атомы в большей части своего объема заполнены электронами и лишь небольшую часть занимает положительно заряженное вещество.
Центральная часть атома получила название ядра. Из опытов следует, что ядро отталкивает α-частицу, причем тем сильнее, чем ближе к ядру она проходит.
На основании опытов Резерфорда и расчетов была предложена планетарная модель атома
Слайд 8 Обладая информацией о построении Периодической системы химических элементов,
можно сделать выводы:
Порядковый номер элемента – это заряд ядра
его атома.Поскольку заряд атома определяется числом протонов, то порядковый номер атома соответствует числу протонов.
Поскольку атом электронейтрален, общее число протонов в ядре атома соответствует числу электронов на электронных оболочках.
Общее число протонов и нейтронов в ядре выражается массовым числом Ar = Np + Nn
Рассчитать число нейтронов в ядре атома можно как разницу между массовым числом и порядковым номером.
Слайд 9 При изменении электронных оболочек атомы превращаются в ионы
– положительно или отрицательно заряженные частицы.
При изменении числа нейтронов
в ядре атома образуются изотопы – вид атома с разным массовым числом.
Слайд 10
Проверь себя! Ответь на вопросы!
Если затрудняешься, нажимай
на ссылки!
В чем заключался опыт Резерфорда? Слайд 5
Какие
выводы были сделаны? Слайд 6Какая модель атомы была предложена? Слайд 6
Какие элементарные частицы (согласно современным представлениям) входят в состав атома? Слайд 7
Каковы основные характеристики элементарных частиц? Слайд 7
Какие данные из Периодической системы химических элементов могут дать информацию о количестве элементарных частиц атома? Слайд 8
Что такое изотопы? Слайд 9
Что такое ионы? Слайд 9
Слайд 11
2. Строение электронных оболочек атомов
Исследования Нильса Бора – основоположника
современной атомной физики, а также ряда других ученых позволили
сделать вывод: электроны в атомах располагаются определенными слоями – оболочками и в определенном порядке.Двигаясь вокруг атома, электроны образуют его электронную оболочку.
Строение электронных оболочек атомов играет важную роль в химии, так как именно электроны (особенно внешнего электронного слоя) обуславливают свойства атомов. Важнейшей характеристикой движения электрона на определенной орбитали является энергия его связи с ядром.
Попытаемся ответить на вопросы:
Как движутся электроны вокруг ядра?
Беспорядочно или в определенном порядке?
Слайд 12 Строение электронных оболочек атомов играет важную роль в
химии, так как именно электроны (особенно внешнего электронного слоя)
обуславливают свойства атомов.Важнейшей характеристикой движения электрона на определенной орбитали является энергия его связи с ядром.
Электроны в атоме различаются определенной энергией, и, как показывают опыты, одни притягиваются к ядру сильнее, другие слабее. Объясняется это удаленностью электронов от ядра.
Чем ближе электроны к ядру, тем больше связь с ядром, но меньше запас энергии. По мере удаления от ядра атома сила притяжения электрона к ядру уменьшается, запас энергии увеличивается. Так образуются электронные слои в электронной оболочке атома.
ВАЖНЕЙШИЕ ПОНЯТИЯ
Слайд 13 Электроны, обладающие близкими значениями энергии, образуют единый электронный
слой, или энергетический уровень.
На первой оболочке располагается не более
двух электронов, на второй – не более восьми, на третьей – не более 18, на четвертой – не более 32. Известно, что на внешнем энергетическом уровне может находиться не более восьми электронов, его называют завершенным.
Электронные слои, не содержащие максимального числа электронов, называют незавершенными.
Число электронов на внешнем энергетическом уровне электронной оболочки атома равно номеру группы для химических элементов главных подгрупп.
Слайд 14 Электрон движется не по орбите, а по орбитали,
и не имеет траектории.
Пространство вокруг ядра, где наиболее вероятно
нахождение данного электрона, называется орбиталью этого электрона, или электронным облаком.Орбитали, или подуровни, могут иметь разную форму, их количество соответствует номеру уровня, но не превышает четырех.
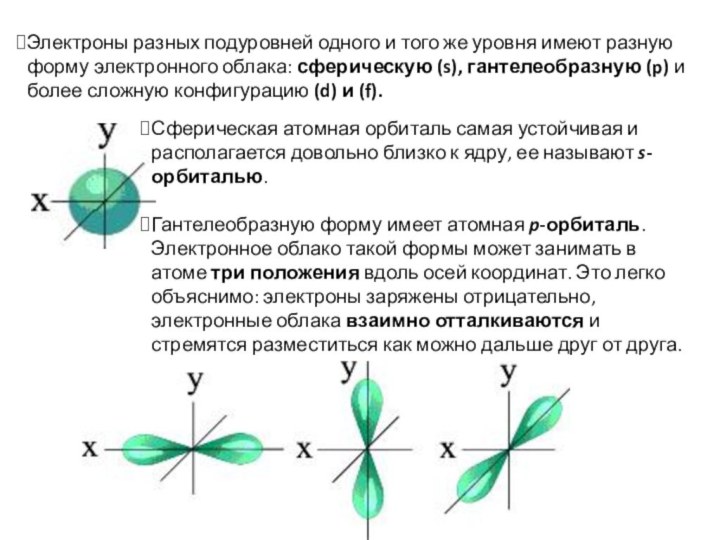
Слайд 15 Электроны разных подуровней одного и того же уровня
имеют разную форму электронного облака: сферическую (s), гантелеобразную (p) и
более сложную конфигурацию (d) и (f).Сферическая атомная орбиталь самая устойчивая и располагается довольно близко к ядру, ее называют s-орбиталью.
Гантелеобразную форму имеет атомная p-орбиталь.
Электронное облако такой формы может занимать в атоме три положения вдоль осей координат. Это легко объяснимо: электроны заряжены отрицательно, электронные облака взаимно отталкиваются и стремятся разместиться как можно дальше друг от друга.
Слайд 16
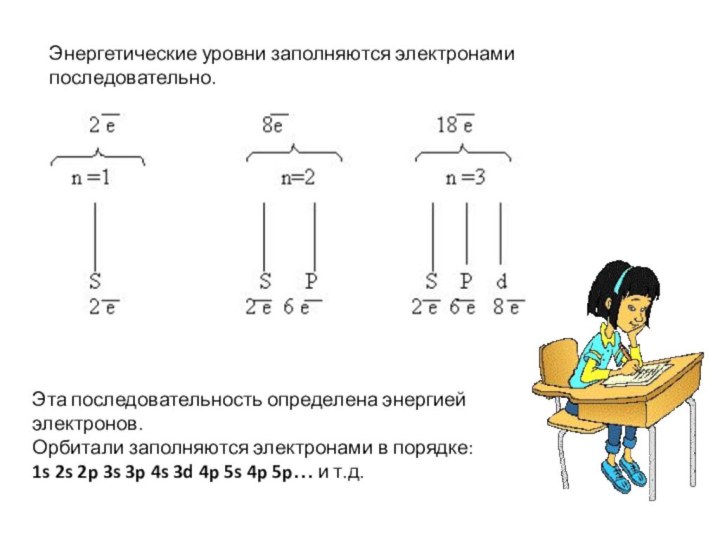
Энергетические уровни заполняются электронами последовательно.
Эта последовательность определена энергией
электронов.
Орбитали заполняются электронами в порядке:
1s 2s 2p
3s 3p 4s 3d 4p 5s 4p 5p… и т.д.
Слайд 17
Алгоритм составления электронных формул атомов
Определяем общее число электронов
на оболочке по порядковому номеру элемента.
Определяем число энергетических уровней
в электронной оболочке - их число равно номеру периода в таблице Д. И. Менделеева, в котором находится элемент.Определяем число электронов на каждом энергетическом уровне.
Используя для обозначения уровня арабские цифры и обозначая орбитали буквами s и p, а число электронов данной орбитали арабской цифрой верхним индексом, изображаем строение атомов электронными формулами.
Слайд 18
Примеры.
1. Ядро атома водорода имеет заряд +1, поэтому
вокруг его ядра движется только один электрон на единственном
энергетическом уровне. Запишем электронную конфигурацию атома водорода:H 1s1
2. Ядро атома азота имеет заряд +7, следовательно в составе электронной оболочки 7 электронов. Атом расположен во 2-м периоде, следовательно электроны располагаются на двух электронных слоях. Поскольку на 1-м слое не может быть больше 2-х электронов, расположение электронов по слоям будет: на первом слое 2 электрона (это s-электроны), на 2-м слое 5 электронов (2 из них являются s-электронами, 3 – p-электронами). Запишем электронную конфигурацию атома азота:
N 1s22s22p3
Слайд 19
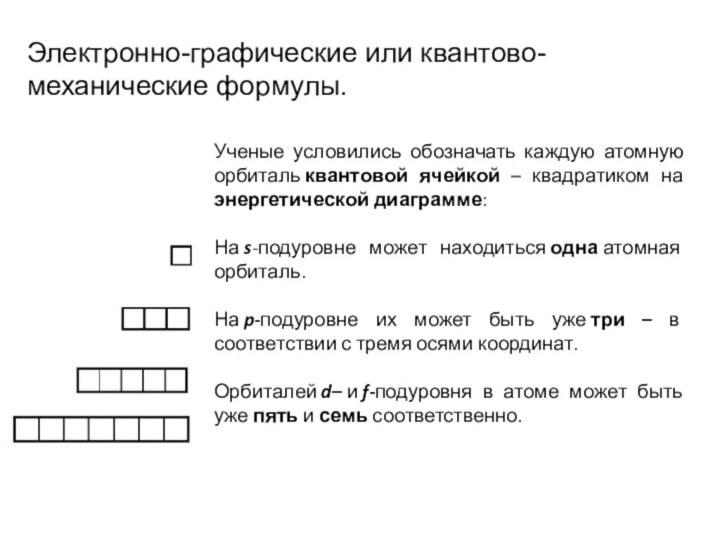
Электронно-графические или квантово-механические формулы.
Ученые условились обозначать каждую атомную
орбиталь квантовой ячейкой – квадратиком на энергетической диаграмме:
На s-подуровне может находиться одна атомная
орбиталь.На p-подуровне их может быть уже три – в соответствии с тремя осями координат.
Орбиталей d– и f-подуровня в атоме может быть уже пять и семь соответственно.
Слайд 20 Ядро атома водорода имеет заряд +1, поэтому вокруг
его ядра движется только один электрон на единственном энергетическом
уровне. Запишем электронную конфигурацию атома водорода.Следующий за водородом элемент-гелий. Ядро атома гелия имеет заряд +2, поэтому атом гелия содержит два электрона на первом энергетическом уровне. Так как на первом энеретическом уровне может находиться не более двух электронов, то он считается завершенным.
Примеры:
Слайд 21
Принципы заполнения электронных орбиталей атомов:
Принцип Паули: на каждой
орбитали может находиться не более двух электронов (c противоположными спинами).
Правило
Клечковского (принцип наименьшей энергии): в основном состоянии каждый электрон располагается так, чтобы его энергия была минимальной.Энергия орбиталей возрастает в ряду:
1S < 2s < 2p < 3s < 3p < 4s < 3d < 4p < 5s < 4d < 5p < 6s < 5d » 4f < 6p < 7s.
Правило Хунда: атом в основном состоянии должен иметь максимально возможное число неспаренных электронов в пределах определенного подуровня
Слайд 22
Проверь себя! Ответь на предложенные вопросы.
При затруднении
нажми на ссылку…
Одинаковы ли электроны в атоме? Слайд 12
Что
такое электронный слой? Слайд 13Что такое электронная орбиталь? Слайд 14
Является ли завершенным 2-й электронный слой, если на нем содержится 7 электронов? Слайд 13
Назови формы и обозначения электронных орбиталей. Слайд 15
Каждый электронный слой начинает заполняться ___-электронами, поскольку их энергия минимальна.Слайд 16
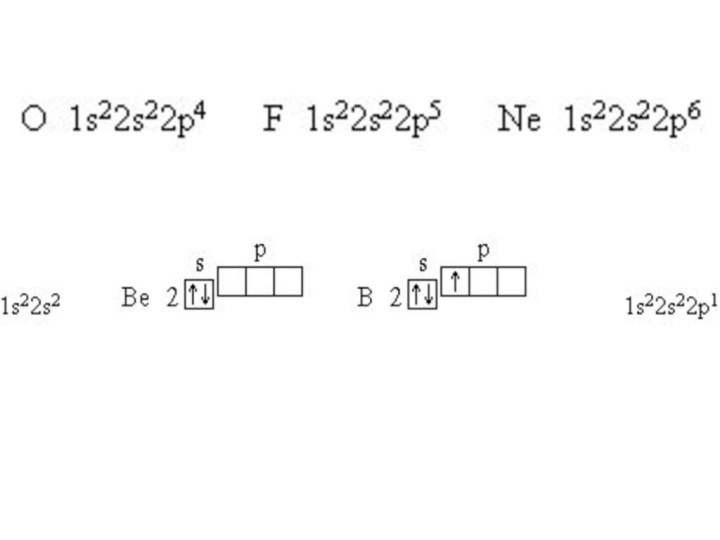
Электронная формула атома бериллия: _______Слайд 24
Электронная формула атома бора: _______Слайд 24
Электронная формула атома кислорода: __________Слайд 24
Электронная формула атома фтора: ________Слайд 24
Электронная формула атома неона: ___________Слайд 24
Слайд 23
Задания для самопроверки Ответы: Слайд 25
Электронная конфигурация атома
азота выражается формулой …
Электронная формула 1s22s22p63s23p1 соответствует атому
…Количество p-электронов на внешнем электронном слое атома фосфора равно …
Атом, имеющий конфигурацию внешнего слоя ns2np3, расположен в … группе.
Число неспаренных электронов атома серы равно …
В ионе S-2 содержится электронов …
Атом, электронная конфигурация которого 1s22s22p63s23p5, в летучем водородном соединении проявляет валентность, равную …