физические и химические свойства спиртов, показать зависимость свойств вещества
от строения молекул;рассмотреть общие способы получение спиртов
закрепить представления о применении веществ, основанном на их свойствах.
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Email: Нажмите что бы посмотреть











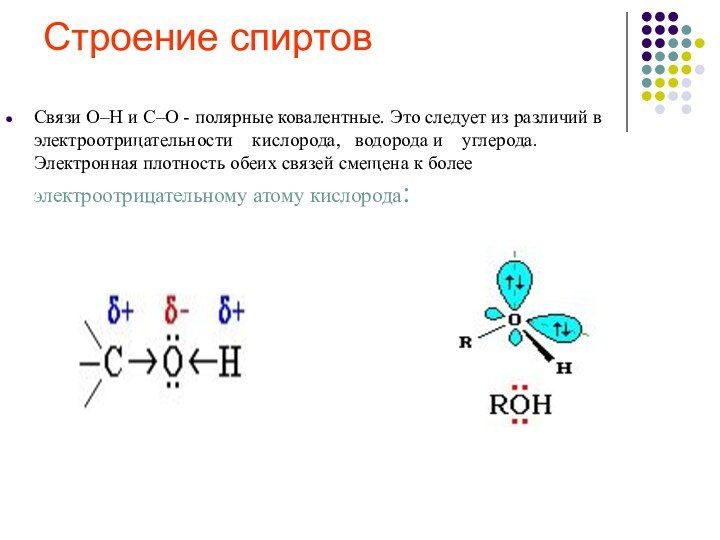












R
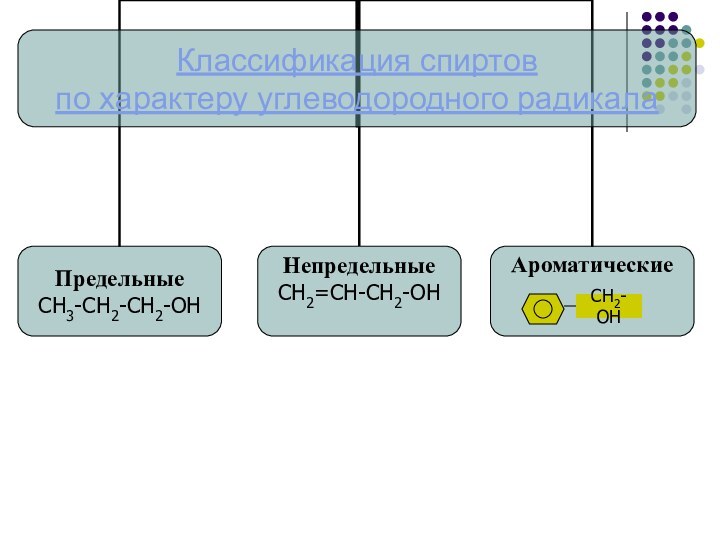
углеводородный радикал
углеводородный радикал + ОЛ
СН2-СН - СН2 –СН2
│ │ │
ОН ОН ОН
1+2+4=7
1+3+4=8
1
2
3
4
Бутантриол -1,2,4
СnH2n+1OH
алкоголят