- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему 1,2-ДИМЕТИЛБЕНЗОЛ
Содержание
- 2. История открытияВпервые бензол описал немецкий химик Иоганн
- 3. Второе рождение Своё второе рождение бензол получил
- 4. Новое получение В 1833 году немецкий физико-химик
- 5. Многие химики-органики, в том числи и Август-Вильгельм
- 6. Но структуру бензола удалось установить лишь в
- 7. Строение бензолаВ свое время было предложено многовариантов
- 8. Образование σ-связей в бензольном кольце. Для
- 9. Образование единой П -электронной системы Негибридные р-
- 10. Квантовомеханическая теория и молекула бензола Немецкий химик Э.
- 12. Понятие арены (ароматические углеводороды)Соединения углерода с водородом,
- 13. Гомологи бензолаПри замещении водородных атомов в молекуле
- 14. Изомерия гомологов бензолаизомерия радикалов;количество радикалов;положение радикалов в бензольном ядре.
- 15. АреныНоменклатура и изомерияизопропилбензол (кумол) пропилбензол
- 16. АреныНоменклатура и изомерияо-ксилол(1,2-диметилбензол) м-ксилол(1,3-диметилбензол) п-ксилол(1,4-диметилбензол)
- 17. АреныНоменклатура и изомерияо-ксилол(1,2-диметилбензол) м-ксилол(1,3-диметилбензол) п-ксилол(1,4-диметилбензол) этилбензол
- 18. АреныНоменклатура и изомерияо-ксилол(1,2-диметилбензол) м-ксилол(1,3-диметилбензол) п-ксилол(1,4-диметилбензол) этилбензол
- 19. Физические свойства Бензол представляет собой бесцветную, легкоподвижную
- 20. Химические свойства 1.Горение бензола:2С6Н6 + 15О2 =
- 21. ПолучениеБензол получают из каменноугольной смолы, образующейся при
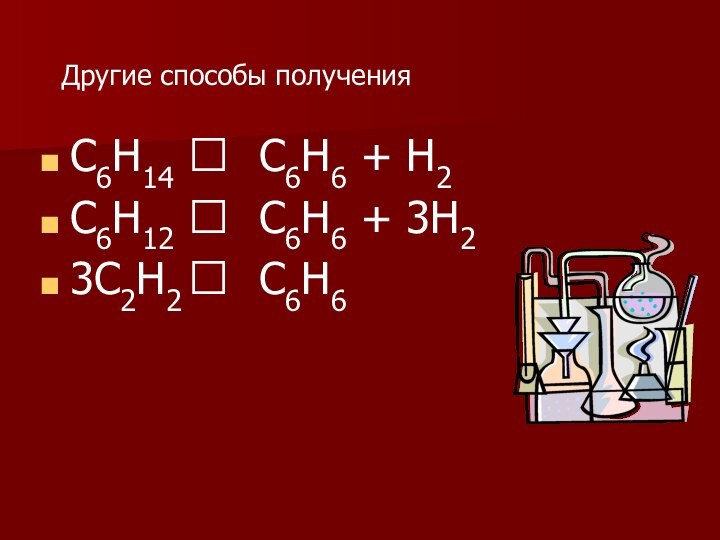
- 22. Другие способы полученияС6Н14 С6Н6 + Н2С6Н12 С6Н6 + 3Н23С2Н2 С6Н6
- 23. Природные источники получения:Природные и попутные газы НефтьКаменный уголь
- 24. Применение
- 25. Проверь себя Выбери правильный ответ.1. Бензол
- 26. 3. Бензол в воде: а) растворяется
- 27. 5. Для бензольного ядра характерна а)
- 28. Скачать презентацию
- 29. Похожие презентации
История открытияВпервые бензол описал немецкий химик Иоганн Глаубер, который получил это соединение в 1649 году в результате перегонки каменно-угольной смолы. Но ни названия вещество не получило, ни состав его не был известен.
























Слайд 3
Второе рождение
Своё второе рождение бензол получил благодаря
работам Фарадея. Бензол был открыт в 1825 году английским
физиком Майклом Фарадеем, который выделил его из жидкого конденсата светильного газа.
Слайд 4
Новое получение
В 1833 году немецкий физико-химик Эйльгард
Мичерлих получил бензол при сухой перегонке кальциевой соли бензойной
кислоты (именно от этого и произошло название бензол)Слайд 5 Многие химики-органики, в том числи и Август-Вильгельм Гофман
считали, что бензол обладает специфическим запахам. Гофмон однажды подчеркнул,
что одна его знакомая дама как-то раз сказала, что я пахну стираными печатками.Слайд 6 Но структуру бензола удалось установить лишь в 1865
г немецкому химику Фридриху Августу Кекуле. Вот как это
было. Ему однажды пришлось участвовать в качестве свидетеля в судебном процессе по делу об убийстве графини Герлиц. На этом процессе демонстрировалось в качестве улики кольцо графини в виде двух переплетенных змеек, которое похитил преступник. Эти змейки врезались в память ученому. Как-то раз, после долгой работы над учебником, Кекуле уснул, и ему приснились атомы углерода и водорода , сцепленные в нити, которые сближались и свертывались в трубку, напоминая двух змей. Одна из змей вцепилась в собственный хвост, продолжая крутиться. Сон оказался в руку. Кекуле сцепил все атомы углерода в шестиугольник с чередующимися двойными и одинарными связями. Так появилась на свет структурная формула бензола.
Слайд 7
Строение бензола
В свое время было
предложено много
вариантов структурных
формул
бензола, но ни
одна из них не смогла
удовлетворительно
объяснить его
особые свойства.
Цикличность строения
бензола подтверждается
тем фактом, что его
однозамещенные
производные не имеют
изомеров.
Слайд 8
Образование σ-связей в бензольном кольце.
Для бензольного ядра
характерна
SP2 - гибридизация.
Два из трех гибридных электронных
облака образуют две σ-связи между соседними атомами углерода, а третье –между атомами углерода и водорода:
Слайд 9
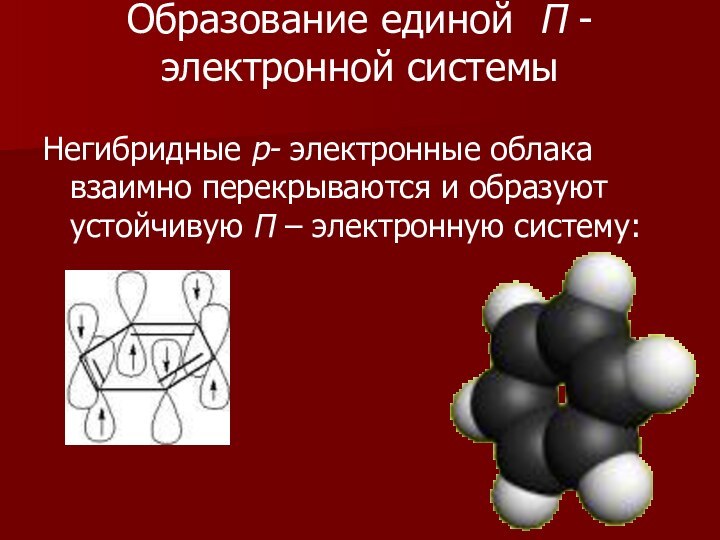
Образование единой П -электронной системы
Негибридные р- электронные облака
взаимно перекрываются и образуют устойчивую П – электронную систему:
Слайд 10
Квантовомеханическая теория и молекула бензола
Немецкий химик Э. Хюккель
применил к ароматическим соединениям квантовомеханическую теорию и показал, что
шесть π-электронов молекулы бензола располагаются в плоскости, перпендикулярной плоскостимолекулы, взаимно перекрываются и образуют замкнутое электронное облако.
Слайд 12
Понятие арены
(ароматические углеводороды)
Соединения углерода с водородом,
в молекулах
которых имеется бензольное кольцо, или ядро, относятся к ароматическим
углеводородам.
Слайд 13
Гомологи бензола
При замещении водородных атомов в молекуле бензола
различными радикалами образуются гомологи бензола:
C6Н5 –СН3
– метилбензолC6Н5 –С2Н5 – этилбензол
C6Н5 –С3Н7 – пропилбензол
Общая формула СnН2n-6
Слайд 14
Изомерия гомологов бензола
изомерия радикалов;
количество радикалов;
положение радикалов в бензольном
ядре.
Слайд 16
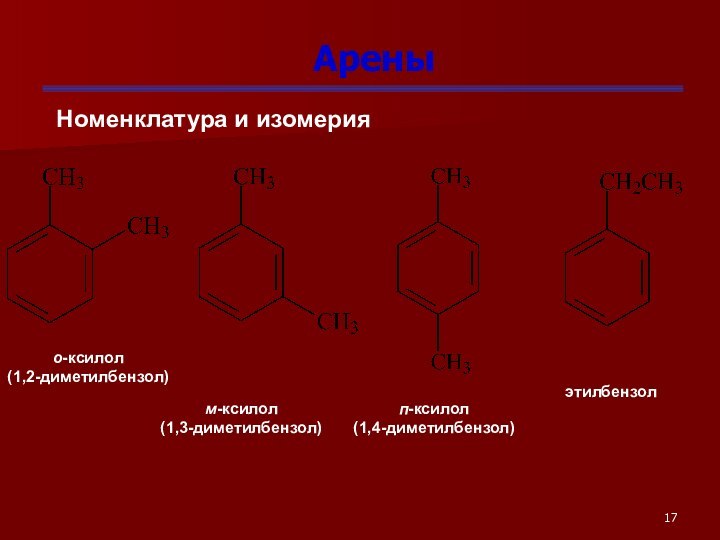
Арены
Номенклатура и изомерия
о-ксилол
(1,2-диметилбензол)
м-ксилол
(1,3-диметилбензол)
п-ксилол
(1,4-диметилбензол)
Слайд 17
Арены
Номенклатура и изомерия
о-ксилол
(1,2-диметилбензол)
м-ксилол
(1,3-диметилбензол)
п-ксилол
(1,4-диметилбензол)
этилбензол
Слайд 18
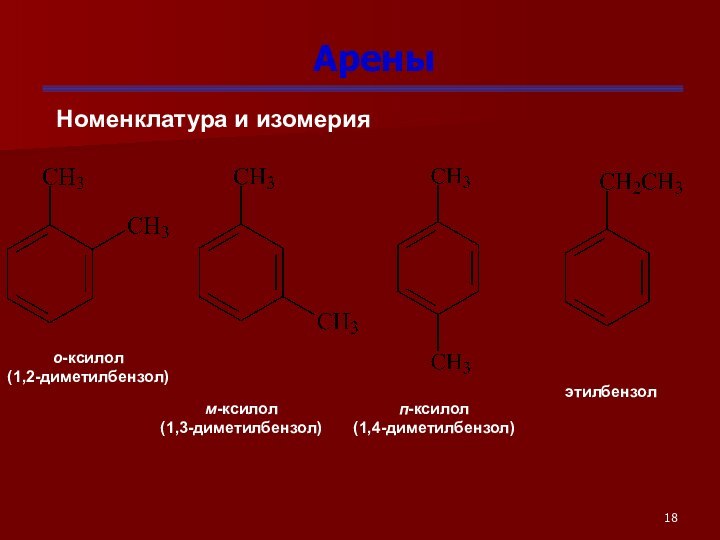
Арены
Номенклатура и изомерия
о-ксилол
(1,2-диметилбензол)
м-ксилол
(1,3-диметилбензол)
п-ксилол
(1,4-диметилбензол)
этилбензол
Слайд 19
Физические свойства
Бензол представляет собой бесцветную, легкоподвижную жидкость
с температурой кипения +80ºС и температурой плавления + 5ºС.
Он
обладает своеобразным запахом, горит сильно коптящим пламенем, легче воды и не растворяется в ней.Пары бензола с воздухом образуют взрывчатую смесь.
Слайд 20
Химические свойства
1.Горение бензола:
2С6Н6 + 15О2 = 12СО2
+ 6Н2О
2. Реакция замещения:
С6Н6 + Br2
C6H5Br + HBr3. Нитрование:
С6Н6 + НОNО2 С6Н5NО2 + Н2О
4. Гидрирование:
С6Н6 + 3Н2 С6Н12
5. Хлорирование:
С6Н6 + 3 Cl2 C6H6Cl6
Слайд 21
Получение
Бензол получают из каменноугольной смолы, образующейся при коксовании
угля.
В настоящее время бензол получают из нефти.
Бензол получают синтетическими
методами.
Слайд 25
Проверь себя
Выбери правильный ответ.
1. Бензол относится
к гомологическому ряду:
а) алканов; б) алкенов;
в) алкинов; г) аренов.
2. Брутто-формула бензола - это:
а) С6Н6; б) С6Н14; в) С6Н12; г) С6Н10
Слайд 26
3. Бензол в воде:
а) растворяется неограничено;
б) не растворяется;
в) растворяется при нагревании;
г) не растворяется при нагревании.4. Общая формула аренов:
а) С2nН2n+2 ; б) С2nН2n ;
в) С2nН2n-2 ; г) С2nН2n-6
Слайд 27
5. Для бензольного ядра характерна
а) sp
гибридизация;
2б) sp гибридизация;
3
в) sp гибридизация;
4
г) sp гибридизация.
6. Среди приведенных реакций укажите реакцию гидротации:
а) С6Н6 + О2 →
б) С6Н6 + НCl →
в) С6Н6 + Н2→
г) С6Н6 + НNO3→