Слайд 2
1. Характеристика неметалла на примере азота
Положение N в
Периодической системе и строение его атома
а) Положение N в
Периодической системе
N порядковый номер – 7
2 (малый) период, V группа, главная подгруппа
Слайд 3
1. Характеристика неметалла на примере азота
б) Состав атома
P+
= 7 (порядковый номер)
ē = P+ = 7
n0 =
Ar - № = 14-7=7
Слайд 4
1. Характеристика неметалла на примере азота
в) строение атома
N:
Число энергетических уровней = номеру периода = 2
Число ē
на последнем уровне = номеру группы, в котором находится элемент, т.е. 5.
N+7 )) 1s2 2s2 2p3
2 5
2
2
3
Слайд 5
1. Характеристика неметалла на примере азота
У атома азота
на внешнем электронном слое
находится 5 электронов, до завершения не
хватает
3 электрона (8-5), атом азота может и принимать, и отдавать электроны в химических реакциях,
проявляя как окислительные, так и восстановительные свойства.
N0 + 3 ē → N-3 (восстановление, окисилитель)
N0 - 5ē→N+5 (окисление, восстановитель)
Слайд 6
1. Характеристика неметалла на примере азота
Электроотрицательность – способность
атомов химических элементов оттягивать к себе электроны атомов.
Самый электроотрицательный
элемент- F, затем O, затем N.
Азот – третий по электроотрицательности элемент.
Слайд 7
1. Характеристика неметалла на примере азота
Слайд 8
2. Сравнение свойств атома азота со свойствами атомов
– соседей по группе и периоду
R АТ (N)
R АТ (P)
Азот – самый сильный окислитель в V группе.
R АТ (С) > R АТ (N) > R АТ (O)
Атомы азота проявляют более сильные окислительные свойства, т.к. обладают:
а) меньшим R ат , чем атомы С
б) и большим числом ē
Но азот менее сильный окислитель, чем кислород.
Слайд 9
3. Простое вещество азот – N2 – неметалл
N2
- к.н.п, газ.
Неметаллические свойства простого вещества азота выражены сильнее,
чем у фосфора.
Неметаллические свойства простого вещества азота выражены сильнее, чем у углерода, но слабее, чем у простого вещества укислорода.
Слайд 10
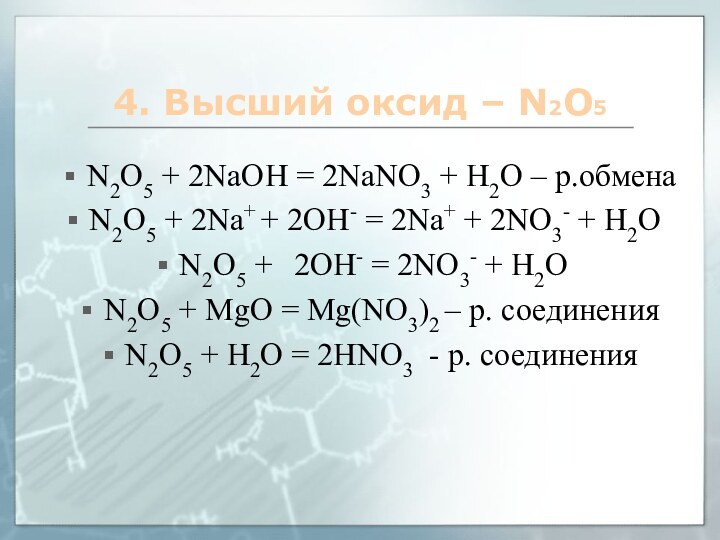
4. Высший оксид – N2O5
Кислотный.
Взаимодействует с
Основаниями
Основными оксидами
водой
Слайд 11
4. Высший оксид – N2O5
N2O5 + 2NaOH =
2NaNO3 + H2O – р.обмена
N2O5 + 2Na+ + 2OH-
= 2Na+ + 2NO3- + H2O
N2O5 + 2OH- = 2NO3- + H2O
N2O5 + MgO = Mg(NO3)2 – р. соединения
N2O5 + Н2О = 2HNO3 - р. соединения
Слайд 12
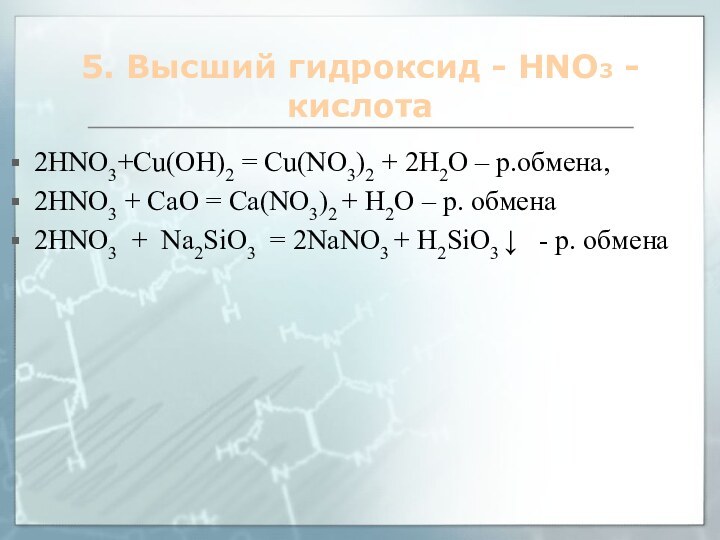
5. Высший гидроксид - HNO3 - кислота
Взаимодействует с
Основаниями
Основными оксидами
Солями
металлами
Слайд 13
5. Высший гидроксид - HNO3 - кислота
2HNO3+Cu(OH)2 =
Cu(NO3)2 + 2H2O – р.обмена,
2HNO3 + СaO = Ca(NO3)2
+ H2O – р. обмена
2HNO3 + Na2SiO3 = 2NaNO3 + H2SiO3 ↓ - р. обмена
Слайд 14
6. NH3 - летучее водородное соединение
Аммиак
Слайд 15
Генетический ряд азота
N2→ N2O5 → HNO3 →NaNO3
Слайд 16
Закрепление знаний . Тестирование
1. Заряд ядра атома азота
равен числу
а) протонов
б)электронов во внешнем электронном слое
в) нейтронов
г)энергетических
уровней
Слайд 17
2. В ряду химических элементов B→C→N
а)усиливаются металлические свойства
б)ослабевают
восстановительные свойства
в)уменьшается электроотрицательность атомов
г)уменьшается высшая степень окисления в оксидах
Слайд 18
3. Значения высшей и низшей степеней окисления азота
соответственно равны
а) +5 и -3
б) +4 и +1
в)+5 и
0
г)+4 и 0
Слайд 19
4. С образованием катионов водорода и анионов кислотного
остатка диссоциирует
а)оксид кремния (IV)
б) оксид меди (II)
в)гидроксид натрия
г)азотная кислота