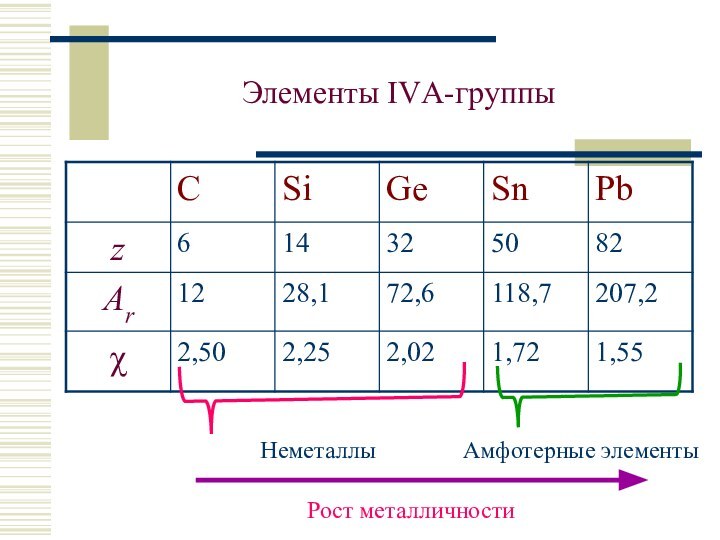
С: 2, 4; Si, Ge, Sn, Pb: 2 ÷ 6
Степени окисления: –IV, 0, +II, +IV
Устойчивые ст.ок.: С, Si, Ge, Sn: +IV
(PbIV – сильн.окисл.). Уст. ст.ок.: Pb: +II
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Email: Нажмите что бы посмотреть

![Характеристика углерода и кремния Общая электронная формула: […] ns 2 (n–1)d 10np2Валентные возможности:](/img/tmb/12/1151102/85b634f809079cac357f27a0dc48c0c9-720x.jpg)



![Характеристика углерода и кремния Простые веществаЭIVAЭГ2, ЭГ4 (Sn, Pb)ЭO, ЭO2 (Sn, Pb)ЭS, ЭS2SiO44–[Э(OH)3]– + H2↑ (Sn,](/img/tmb/12/1151102/575dacfc0cc177bb06bcd973c951f303-720x.jpg)






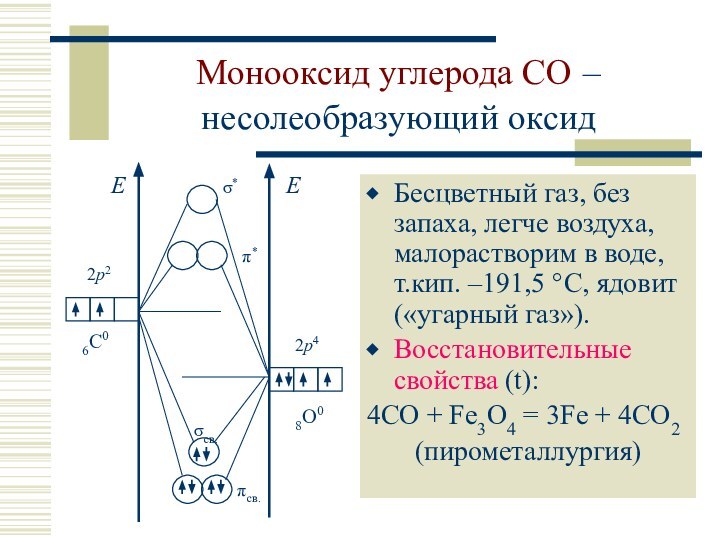
![Характеристика углерода и кремния Монооксид углерода COДонорные свойства: CO образует прочные комплексы, например [Fe(CO)5].: C](/img/tmb/12/1151102/51519b703790bad5d50ee238c9e18851-720x.jpg)




![Характеристика углерода и кремния КремнийХимическое растворение3Si + 4HNO3 + 18HF = 3H2[SiF6] + 4NO↑ + 8H2OSi](/img/tmb/12/1151102/a5d32b995c919a585b49c0472d8f126b-720x.jpg)



Степени окисления: –IV, 0, +II, +IV
Устойчивые ст.ок.: С, Si, Ge, Sn: +IV
(PbIV – сильн.окисл.). Уст. ст.ок.: Pb: +II
Sn2+, Pb2+
Кремний: кварц, яшма, агат, опал, силикаты, алюмосиликаты
СH4, Be2C, Al4C3, SiC
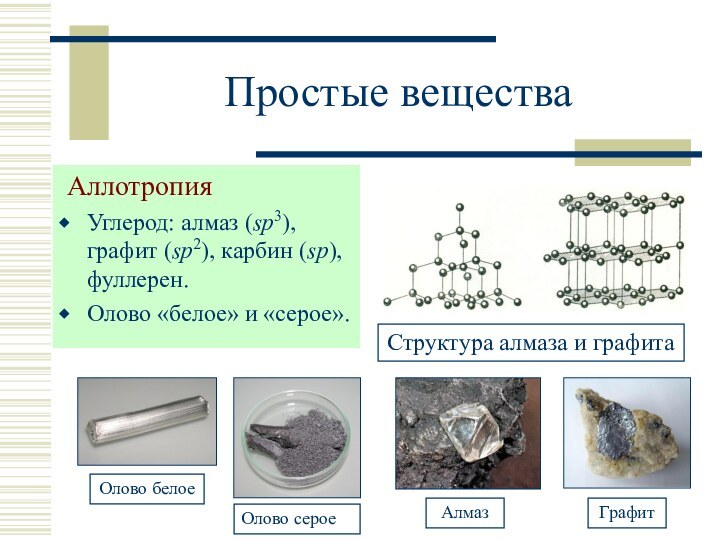
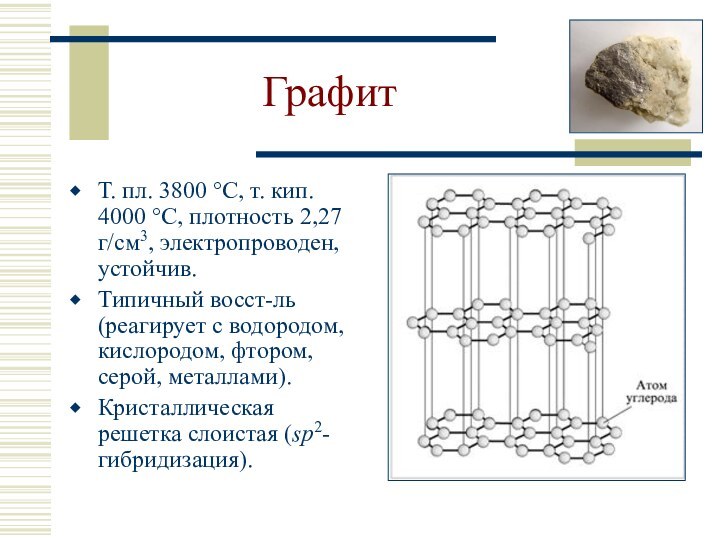
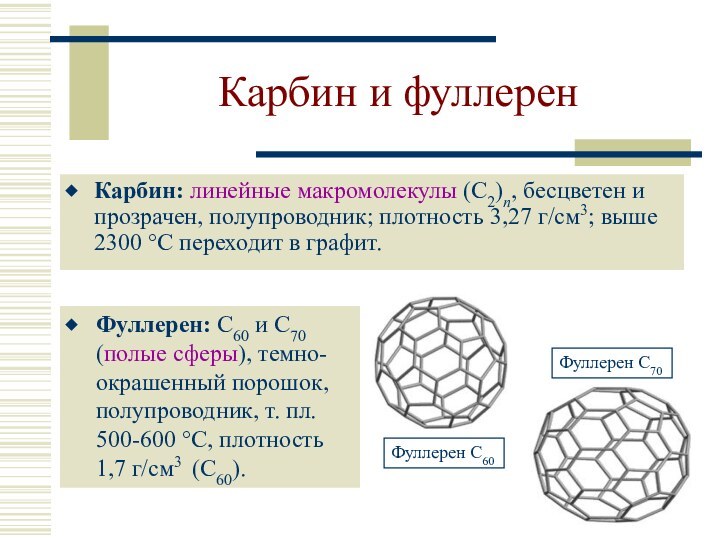
Фуллерен: С60 и С70 (полые сферы), темно-окрашенный порошок, полупроводник, т. пл. 500-600 °C, плотность 1,7 г/см3 (С60).
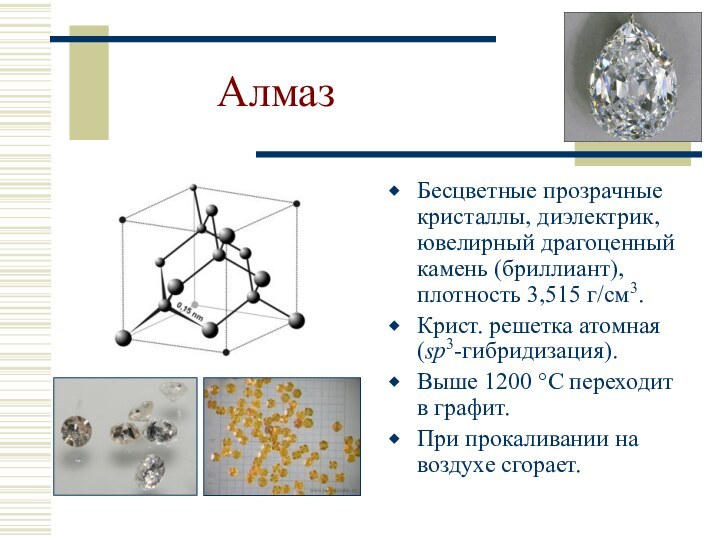
sp3
sp-гибридизация
Соли – карбонаты и гидрокарбонаты M2CO3 и MHCO3 подвергаются гидролизу (рН > 7).
Термическое разложение гидрокарбонатов:
2NaHCO3 = Na2CO3 + CO2↑ + H2O
Видеофрагмент
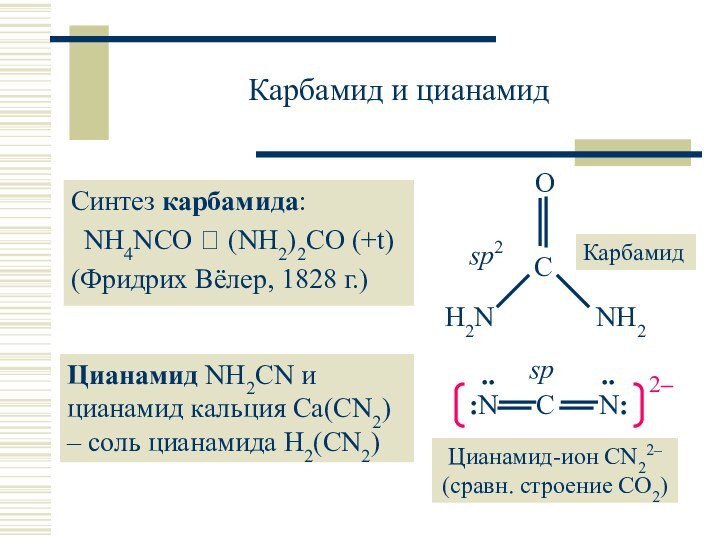
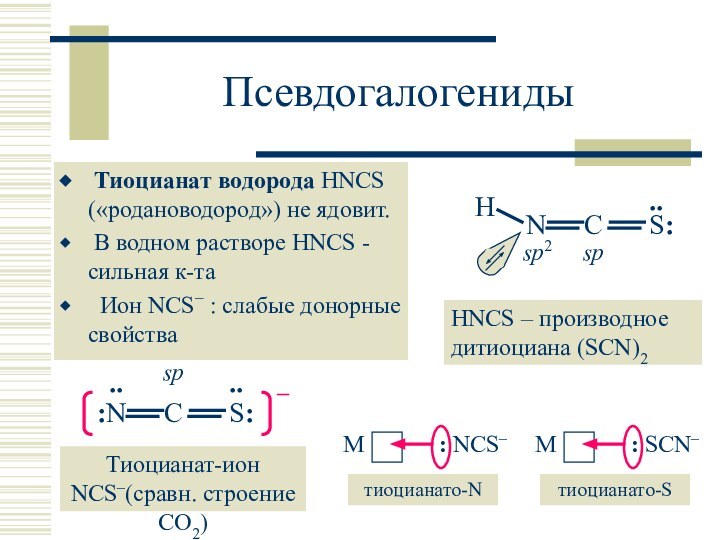
: C:::N–
HCN – производное дициана C2N2
HNCS – производное дитиоциана (SCN)2
Видео: магниетермияВидео: магниетермия и получение силана
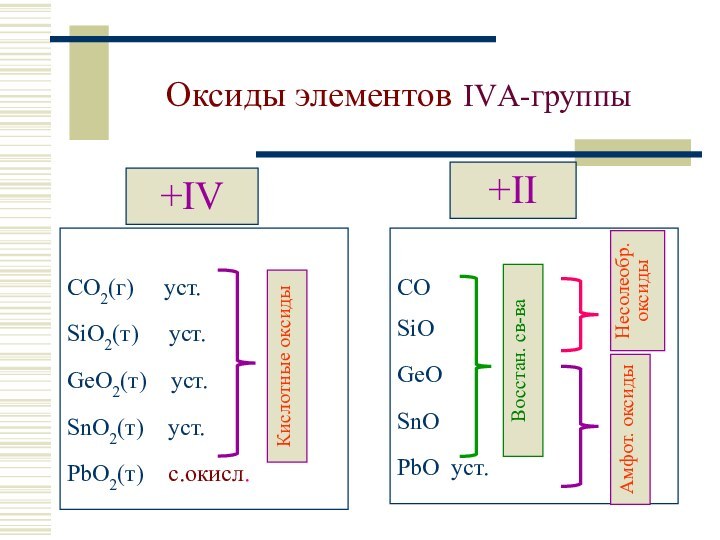
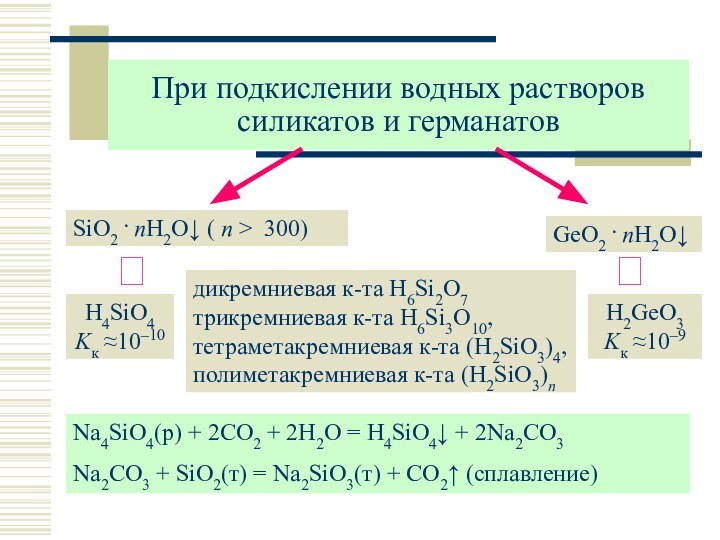
SiO2
GeO2
+ H3O+ ≠