вывести формулы для вычисления скорости гомогенных и гетерогенных реакций
рассмотреть, от каких факторов зависит скорость химических реакцийЦели урока
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Email: Нажмите что бы посмотреть























Цели урока
Демонстрационный опыт
ссылка 1 http:// files.school-collection.edu.ru/dlrstore/b3598a41-f6f7-4bd9-9faf-068f9740dfe5/90.sw
Скорость химической реакции
±
где ΔC – изменение концентрации; ΔC = С2 - С1
Δt – время протекания реакции; Δt = t2 - t1
Перейдите по ссылке 2, выполните задание: http://files.school-collection.edu.ru/dlrstore/a18c4845-b421-e381-70d9-e28ff64396d4/00119986325448946.htm
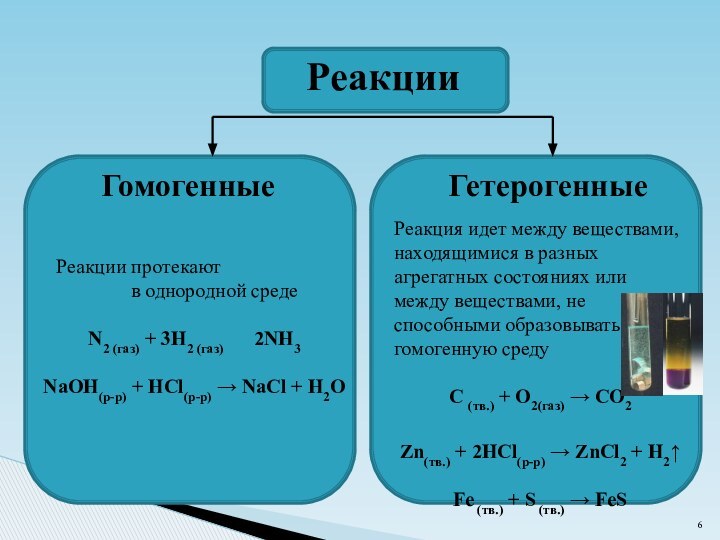
Гетерогенные
Реакция идет между веществами,
находящимися в разных
агрегатных состояниях или
между веществами, не
способными образовывать
гомогенную среду
C (тв.) + O2(газ) → CO2
Zn(тв.) + 2HCl(р-р) → ZnCl2 + H2↑
Fe (тв.) + S (тв.) → FeS
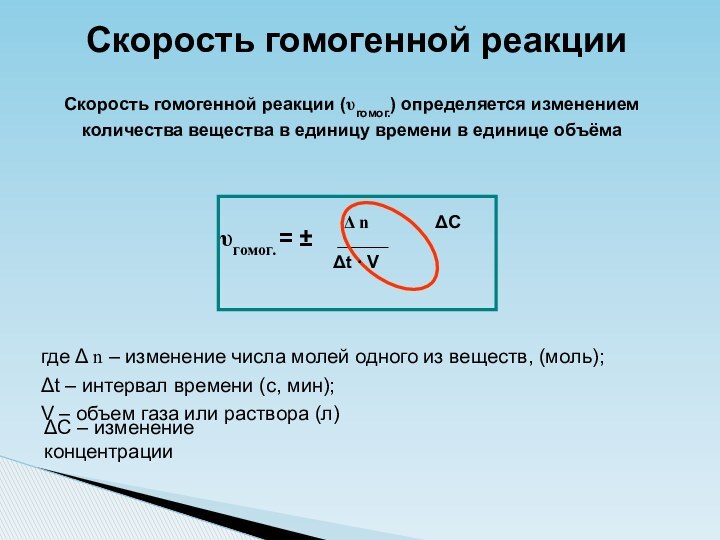
Скорость гомогенной реакции
Δ n
ΔC
ΔC – изменение концентрации
Δt ∙ V
υгетер.
Δt ∙ S
Δ n
= ±
где Δ n – изменение количества вещества (реагента или продукта), (моль);
Δt – интервал времени (с, мин);
S – площадь поверхности соприкосновения веществ (см2, м2)
Упражнение:
http://files.school-collection.edu.ru/dlrstore/00e0adf8-35e6-4b1a-ae0a-437341e187f6/91.swf
Природа реагирующих веществ
Концентрация реагирующих веществ
Математически зависимость скорости от концентрации для реакции: 2А+В=АВ выражается следующим образом:
где k – константа скорости (определяется экспериментально);
[A], [B] – концентрации реагирующих веществ, (моль/л)
Концентрация реагирующих веществ
Образец решения задач.
Решение:
А +2В → С
По закону действующих масс
υ = k ∙ [A] ∙ [B]2
Пусть [A] = а, [B] = в, тогда
υ1 = k ∙ а ∙ в2
υ2 = k ∙ а ∙ (3в)2
υ2 / υ1 = а ∙ 9в2 / а ∙ в2 = 9
Дано:
[B] ↑ в 3 раза
Как изменится
υ
Ответ: скорость реакции увеличится в 9 раз
Образец решения задач.
Дано:
P ↑в 2 раза
Как изменится υ
Решение:
По закону действующих масс
υ = k ∙ [SО2] 2 ∙ [O2]
Пусть [SО2] = а, [O2] = в, тогда
υ1 = k ∙ а2 ∙ в
υ2 = k ∙ (2а)2·2в= к14а2·2в= k ∙ 8а2·в
При повышении давления в 2 раза, объём уменьшается в 2 раза, следовательно концентрация газа кислорода и SO2 увеличится в 2 раза
υ2 / υ1 = k ∙ 8а2·в / k ∙ а2 ∙ в = 8
Ответ: скорость реакции увеличится в 8 раз
Площадь поверхности соприкосновения реагирующих веществ (для гетерогенных реакций)
Решение:
υt2 = υt1 ∙ γ Δt/10
υt2 =1∙330 - 0/10 = 33 = 27 моль/л∙ч
Ответ: Скорость данной реакции при 300С будет равна 27 моль/л∙ч
Вильгельм Оствальд
1909 г. – Нобелевская премия
«в признание работ по катализу»
Герман Иванович Гесс
Один из первых исследователей катализа
В 1831 опубликовал статью, о свойствах
платины, как катализатора.
Посмотрите видеоматериалы: (ссылка 7) http://files.school-collection.edu.ru/dlrstore/b40c134e-f065-1ca4-960d-5d7780bd6a99/index.htm
Влияние катализаторов на скорость химических реакций. (ссылка 8) http://files.school-collection.edu.ru/dlrstore/d71f293e-16d1-974d-7b89-43a7eae8c7fa/index.htm Влияние ингибиторов на скорость химических реакций
Влияние катализатора
Заполните таблицу:
4. В какой из кислот (все 20%-ные) свинец будет растворяться наиболее медленно:
а) уксусная;
б) соляная;
в) серная;
г) йодоводородная.
5. В каком случае скорость реакции наибольшая:
а) цинковая пластина + 10%-ный раствор НСl;
б) цинковые гранулы + 10%-ный раствор НСl;
в) цинковый порошок + 10%-ный раствор НСl;
г) цинковый порошок + 5%-ный раствор НСl.
Тест