- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Химические реакции
Содержание
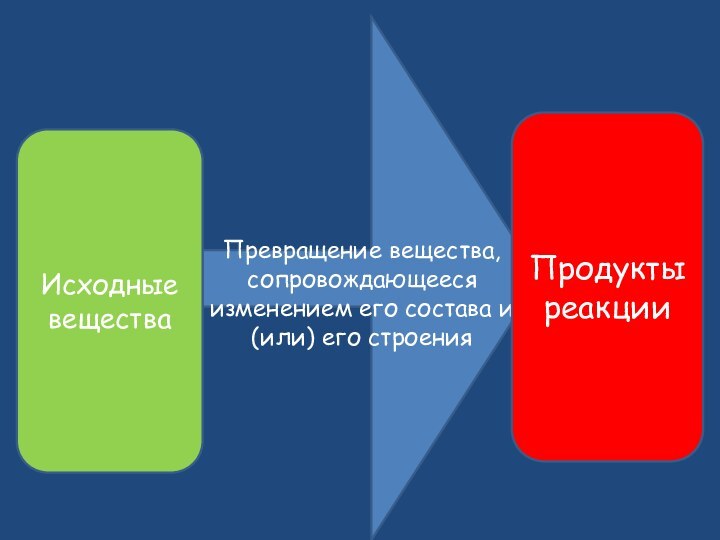
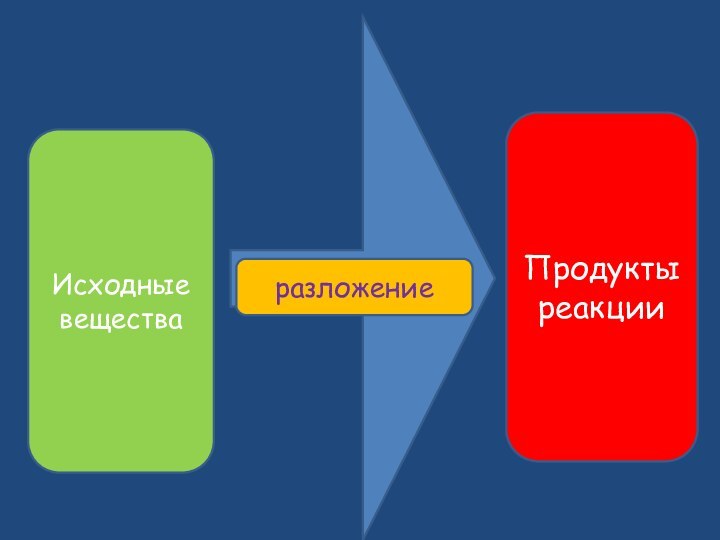
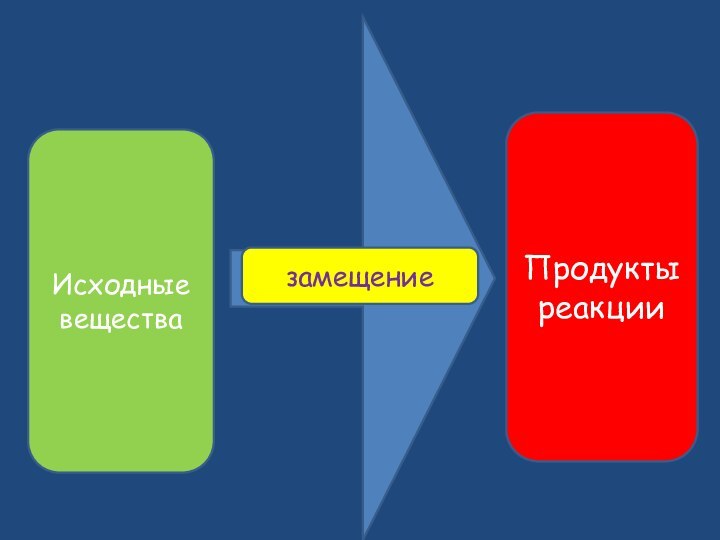
- 2. Превращение вещества, сопровождающееся изменением его состава и (или) его строенияИсходные веществаПродукты реакции
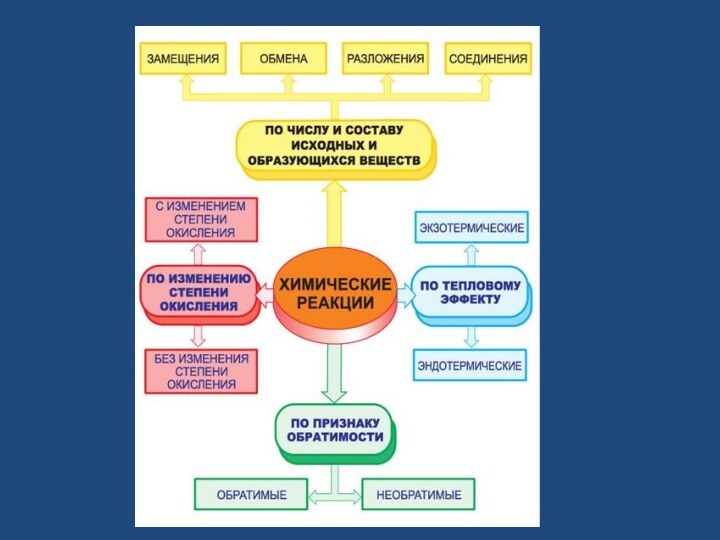
- 3. Признаки химических реакцийВыделение или поглощение газаОбразование осадкаИзменение цвета веществаВыделение или поглощение тепла
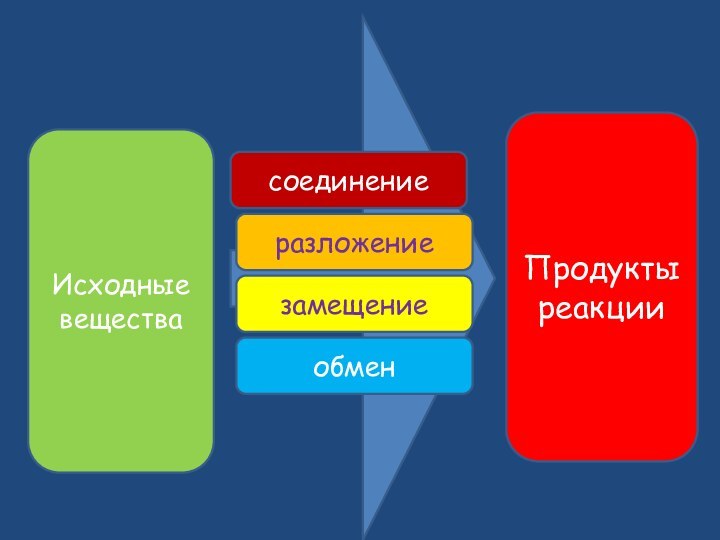
- 8. Исходные веществаПродукты реакциисоединениеразложениезамещениеобмен
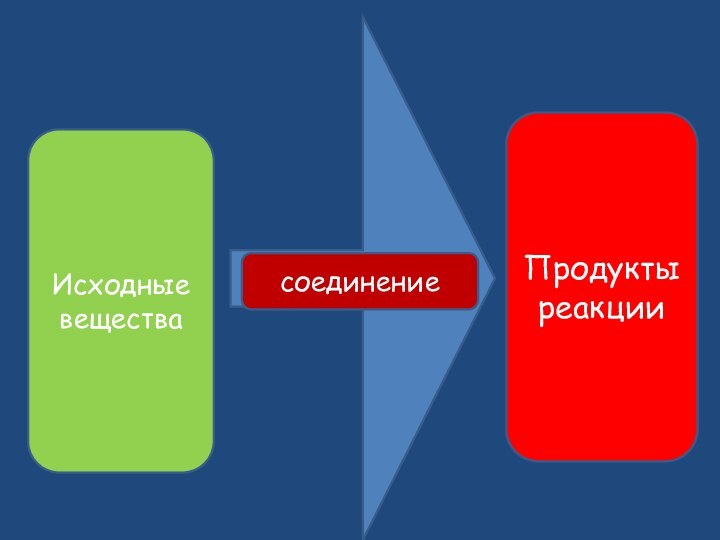
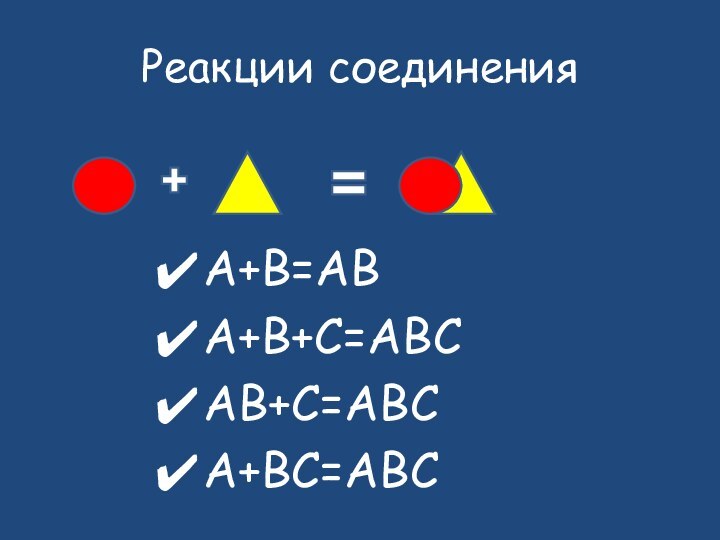
- 9. Исходные веществаПродукты реакциисоединение
- 10. Реакции соединенияА+B=ABA+B+C=ABCAB+C=ABCA+BC=ABC
- 11. 4Fe + 3O2 = 2Fe2O3выделение теплаизлучение светаизменение цвета вещества
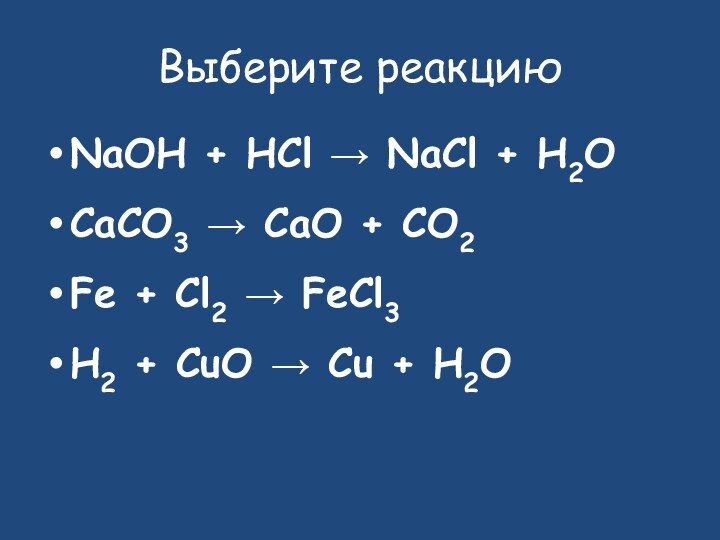
- 12. Выберите реакциюNaOH + HCl → NaCl +
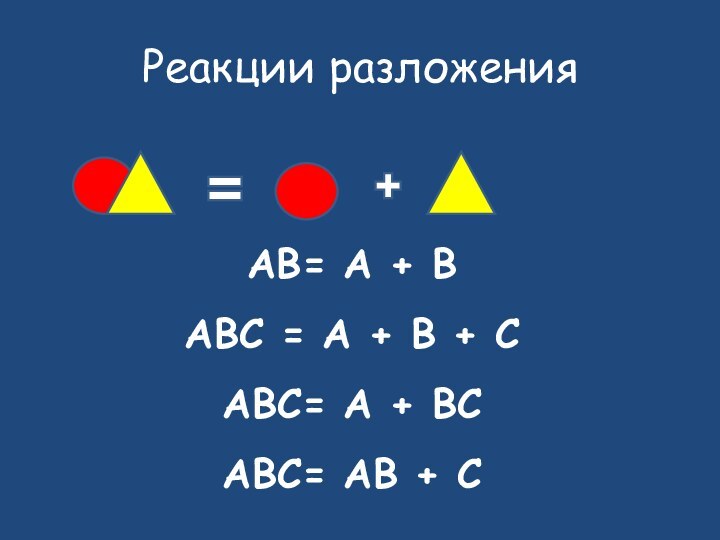
- 13. Исходные веществаПродукты реакцииразложение
- 14. Реакции разложенияAB= A + BABC = A
- 15. (NH4)2Cr2O7 = N2+4H2O+Cr2O3изменение цветавыделение теплавыделение газа
- 16. Выберите реакциюNaOH + HCl → NaCl +
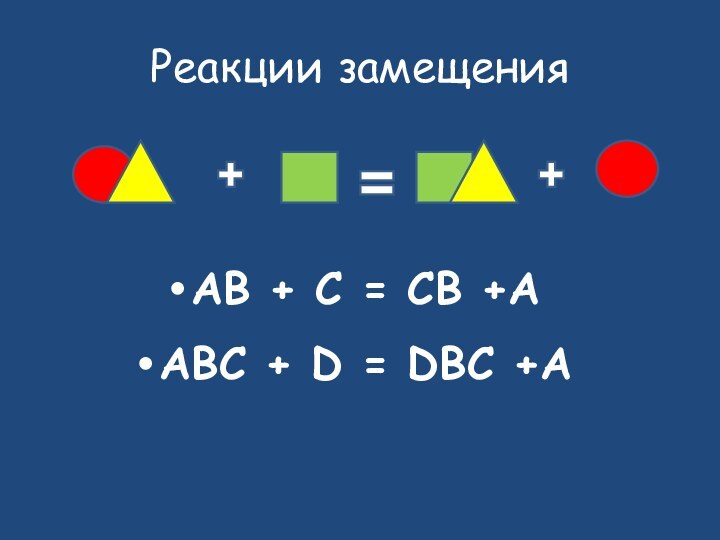
- 17. Исходные веществаПродукты реакциизамещение
- 18. Реакции замещенияAB + C = CB +AABC + D = DBC +A
- 19. Zn + 2HCl = ZnCl2 + H2выделение газарастворение металла
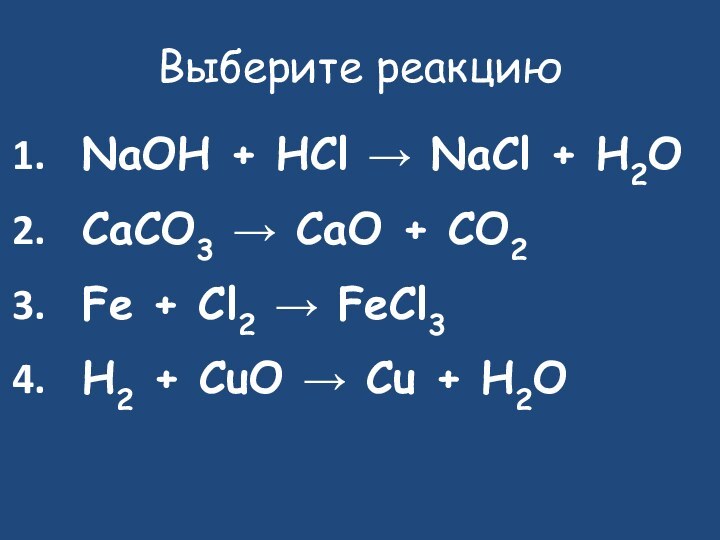
- 20. Выберите реакциюNaOH + HCl → NaCl +
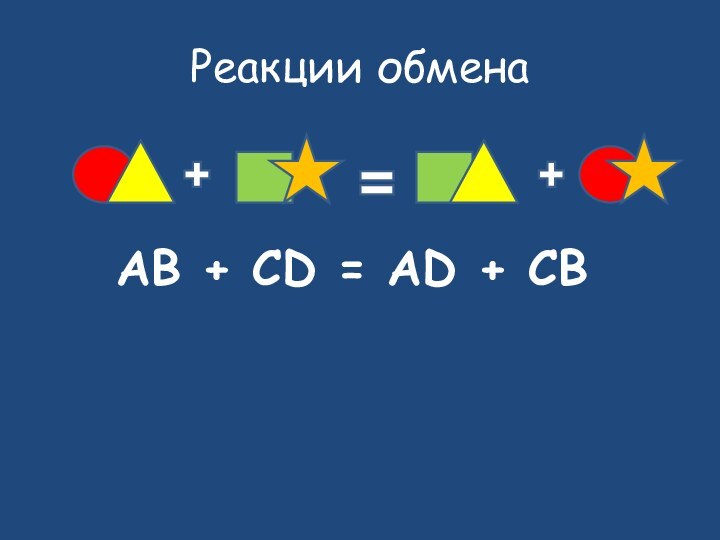
- 21. Исходные веществаПродукты реакцииобмен
- 22. Реакции обменаAB + CD = AD + CB
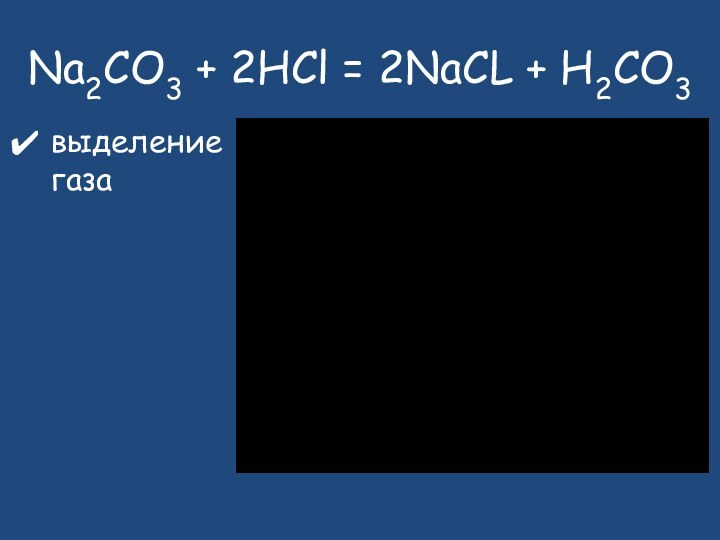
- 23. Na2CO3 + 2HCl = 2NaCL + H2CO3выделение газа
- 24. Выбери реакциюNaOH + HCl → NaCl +
- 25. Закон сохранения массы и энергии. Масса веществ,
- 26. Данный закон позднее (1789 г.) подтвердил французский
- 27. Доказательство закона
- 29. Обратимая реакция - реакция, которая в данных
- 30. Закон Бертоллеосновной закон направления обратимых химических взаимодействий,
- 31. CH4+ 2O2 = CO2 +2H2O + 802
- 32. Определите количество теплоты, которое выделится при образовании
- 33. Реакции, протекающие с выделением теплоты и света называются реакциями горения
- 34. Скачать презентацию
- 35. Похожие презентации
Превращение вещества, сопровождающееся изменением его состава и (или) его строенияИсходные веществаПродукты реакции




















Слайд 3
Признаки химических реакций
Выделение или поглощение газа
Образование осадка
Изменение цвета
вещества
Выделение или поглощение тепла
Слайд 12
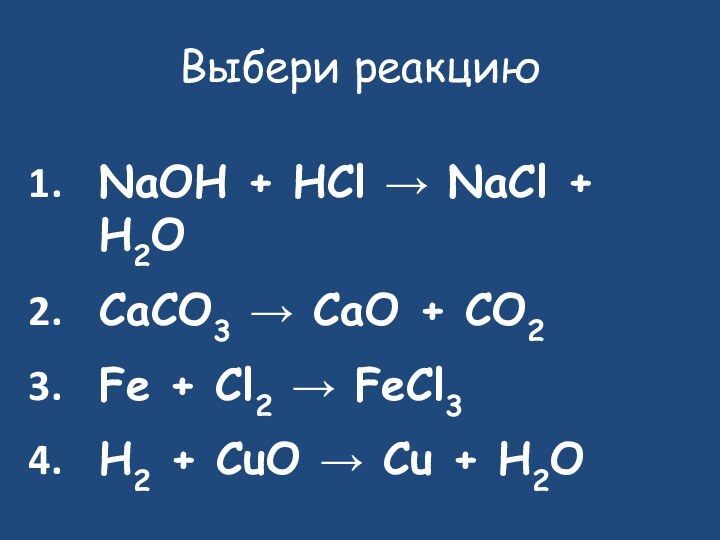
Выберите реакцию
NaOH + HCl → NaCl + H2O
CaCO3
→ CaO + CO2
Fe + Cl2 → FeCl3
H2 +
CuO → Cu + H2O
Слайд 16
Выберите реакцию
NaOH + HCl → NaCl + H2O
CaCO3
→ CaO + CO2
Fe + Cl2 → FeCl3
H2 +
CuO → Cu + H2O
Слайд 20
Выберите реакцию
NaOH + HCl → NaCl + H2O
CaCO3
→ CaO + CO2
Fe + Cl2 → FeCl3
H2 +
CuO → Cu + H2O
Слайд 25
Закон сохранения массы и энергии.
Масса веществ, вступающих
в реакцию равна массе веществ, образующихся в результате реакции.
С
точки зрения атомно-молекулярного учения закон сохранения массы объясняется так:В результате химической реакции атомы не исчезают и не возникают, а происходит их перегруппировка.
Слайд 26 Данный закон позднее (1789 г.) подтвердил французский химик
А. Лавуазье
Все перемены в натуре случающиеся такого суть состояния,
что сколько чего у одного тела отнимется,
столько присовокупится к другому:
так ежели где убудет несколько материи,
то умножится в другом месте….
М. В. Ломоносов, 1756 г.
Слайд 29 Обратимая реакция - реакция, которая в данных условиях
может протекать как в прямом, так и в обратном
направлениях.H2 + I2 ← 2HI
Слайд 30
Закон Бертолле
основной закон направления обратимых химических взаимодействий, который
можно формулировать так: всякий химический процесс протекает в сторону
максимального образования тех продуктов, которые во время реакции выходят из сферы взаимодействия.
Слайд 31
CH4+ 2O2 = CO2 +2H2O + 802 кДж.
Количество теплоты, которое выделяется или поглощается в результате реакций
между определенными количествами реагентов, называют тепловым эффектом химической реакции и обычно обозначают символом Q.Слайд 32 Определите количество теплоты, которое выделится при образовании 120
г MgO в результате реакции горения магния, с помощью
термохимического уравнения 2 Mq + O2 = 2MqO + 1204 кДжДано:
m (Mg0) = 120г
_____________
Q1 -?
Решение:
1) Определяем количества оксида магния, используя формулу для нахождения количества вещества через массу.
n = m / M
n(MqO) = 120г/ 40 г/моль = 3 моль
2) Составляем пропорцию с учетом коэффициентов в уравнении реакции
По уравнению 2 моль MqO - 1204 кДж
По условию 3 моль MqO - Q1
Отсюда Q1= 3 моль* 1204кДж/2моль= 1803 кДж
Ответ: При образовании 120г оксида магния выделится 1803 кДж энергии.





























