- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Химические свойства металлов
Содержание
- 2. Металлы – химические элементы, атомы которых отдают
- 3. Металлы в химических реакциях - восстановителиЭлектрохимический ряд
- 4. Химические свойства металловВзаимодействие металлов с неметаллами:с кислородомЩелочные
- 5. Литий и щелочноземельные металлы взаимодействуют с кислородом,
- 6. Другие металлы взаимодействуют с кислородом менее активно
- 7. 2. С галогенами металлы образуют соли галогеноводородных
- 8. 3.С водородом самые активные металлы образуют гидриды:
- 9. Взаимодействие со сложными веществамиС водой
- 10. 2.С кислотами в растворе взаимодействуют металлы, стоящие
- 11. 3. С растворами солей.Условия взаимодействия:Металл должен находиться
- 12. 4. С органическими веществами.2C2H5OH + 2Na
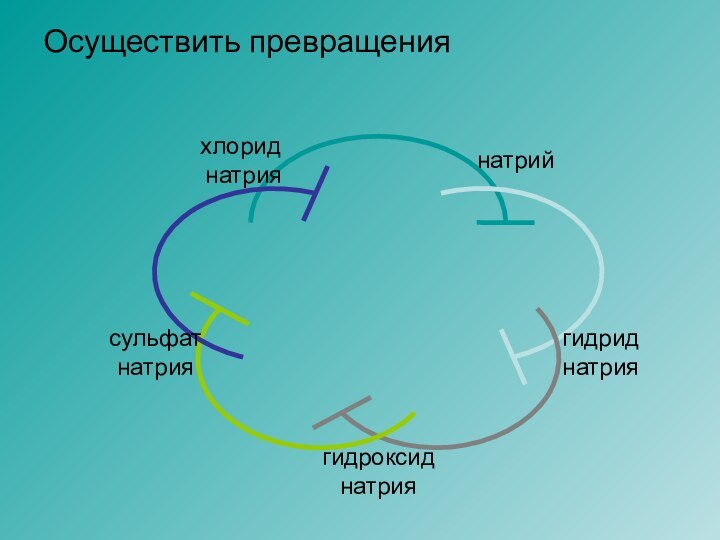
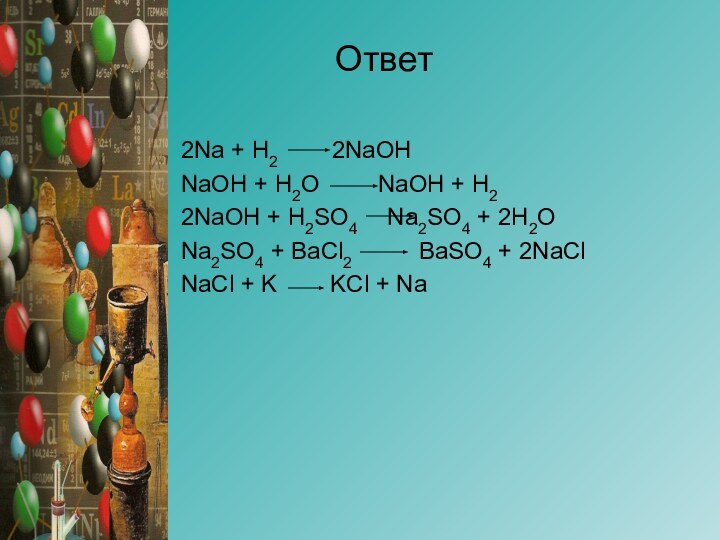
- 13. Осуществить превращения
- 14. Скачать презентацию
- 15. Похожие презентации
Металлы – химические элементы, атомы которых отдают электроны внешнего (или предвнешнего) электронного слоя, превращаясь в положительные ионы.












Слайд 3
Металлы в химических реакциях - восстановители
Электрохимический ряд напряжений
металлов
Li K Ba Ca Na Mg Al Mn Zn
Cr Fe Co Sn Pb (H2) Cu Hg Ag Au Уменьшение восстановительных свойств
Слайд 4
Химические свойства металлов
Взаимодействие металлов с неметаллами:
с кислородом
Щелочные металлы
активно реагируют с кислородом воздуха, образуя пероксиды
0 0 +1 -12Na + O2 = Na2O2
2е пероксид натрия
0 +1 -1 +1 -2
2Na + Na2O2 = 2Na2O
2е оксид натрия
(основный оксид)
Слайд 5 Литий и щелочноземельные металлы взаимодействуют с кислородом, образуя
основные оксиды:
0 0
+1 -24Li + O2 = 2Li2O
4е оксид лития
0 0 +2 -2
2Ca + O2 = 2CaO
4е оксид кальция
Слайд 6 Другие металлы взаимодействуют с кислородом менее активно или
при нагревании:
0 0
+3 -24Al + 3O2 = 2Al2O3
4е оксид алюминия
(амфотерный оксид)
0 0 +2 -2
2Cu + O2 → 2CuO
4е оксид меди(II)
(основный оксид)
t
Слайд 7
2. С галогенами металлы образуют соли галогеноводородных кислот:
0 0 +2
-1Mg + Cl2 = MgCl2
2е хлорид магния
0 0 +3 -1
2Fe + 3Cl2 = 2FeCl3
6е хлорид железа(III)
Слайд 8
3.С водородом самые активные металлы образуют гидриды:
0 0 +2 -1
Са
+ Н2 → СаН22е гидрид кальция
4. С серой металлы образуют соли– сульфиды:
0 0 +2 -2
Fe + S → FeS
2е сульфид железа
Слайд 9
Взаимодействие со сложными веществами
С водой
0 +1
+1 02Na + 2H2O = 2NaOH + H2↑
гидроксид натрия
0 +1 +2 0
Ba + 2H2O = Ba(OH)2 + H2↑
гидроксид бария
растворимые основания– щелочи
Слайд 10 2.С кислотами в растворе взаимодействуют металлы, стоящие в
ряду напряжений до водорода.
2Al + 6HCl = 2AlCl3 +
3H2↑2CH3COOH + Mg (CH3COO)2Mg + H2↑
Слайд 11
3. С растворами солей.
Условия взаимодействия:
Металл должен находиться в
ряду напряжений левее металла, образующего соль
В результате реакции должна
образоваться растворимая соль.Cu + 2AgNO3 = Cu(NO3)2 + 2Ag
Слайд 12
4. С органическими веществами.
2C2H5OH + 2Na
2C2H5ONa + H2↑
2CH3Cl + 2Na C2H6 +
2NaCl5. Со щелочами в растворе
(взаимодействуют металлы, гидроксиды которых амфотерны).
2Al + 2KOH + 6H2O = 2K[Al(OH4)] + 3H2↑





























