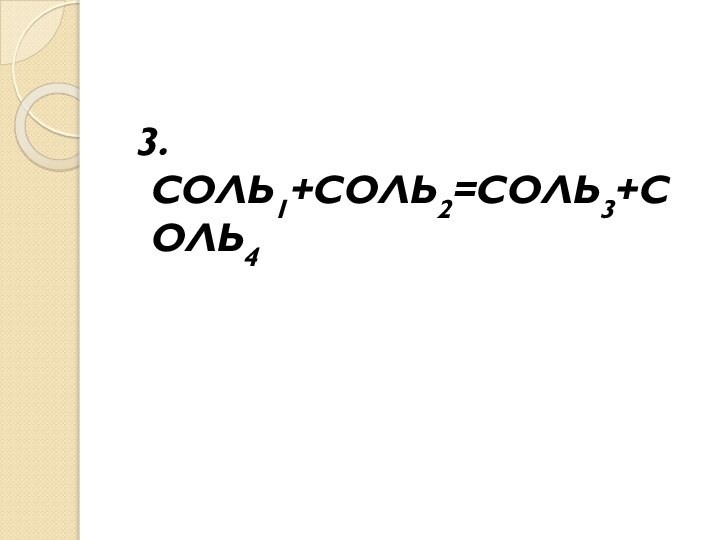- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Химические свойства солей
Содержание
- 2. Кто хочет съесть ядро ореха, должен расколоть
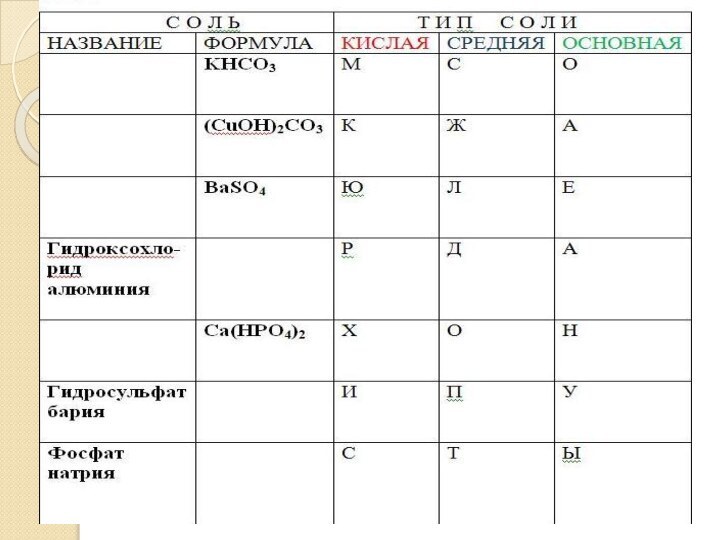
- 4. Вычеркните «лишние» формулы и допишите предложения.
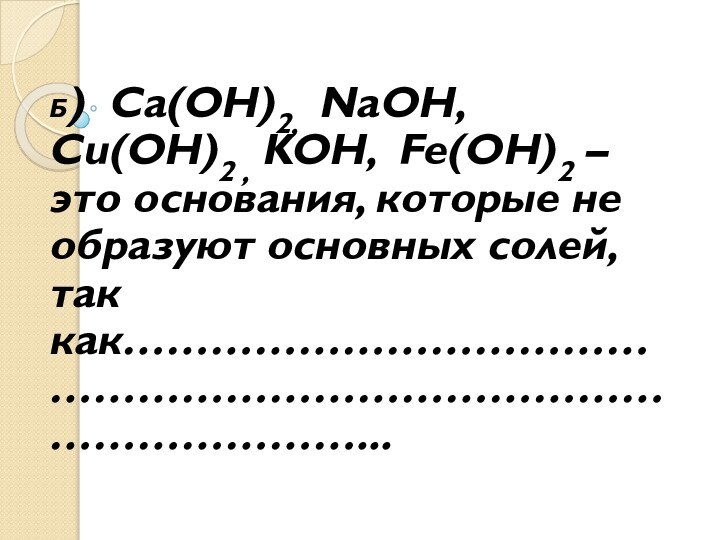
- 5. Б) Ca(OH)2, NaOH, Cu(OH)2 ,
- 7. ХИМИЧЕСКИЕ СВОЙСТВА СОЛЕЙ
- 8. ТИПИЧНЫЕ РЕАКЦИИ СОЛЕЙСОЛЬ+ КИСЛОТА= ДРУГАЯ СОЛЬ+ ДРУГАЯ КИСЛОТА
- 9. 2.СОЛЬ+ ЩЕЛОЧЬ= ДРУГАЯ СОЛЬ+ДРУГОЕ ОСНОВАНИЕ
- 10. 3.СОЛЬ1+СОЛЬ2=СОЛЬ3+СОЛЬ4
- 12. 4.СОЛЬ+ МЕТАЛЛ= ДРУГАЯ СОЛЬ+ ДРУГОЙ МЕТАЛЛ
- 13. экспериментЖелезо + сульфат меди(II)=Железо + хлорид бария =
- 14. Н.Н БЕКЕТОВ В 1865г ИЗУЧИЛ
- 15. В 1892 Г В. НЕРНСТ ДОКАЗАЛ,
- 16. ПРАВИЛА РЯДА НАПРЯЖЕНИЙ:МЕТАЛЛ ДОЛЖЕН НАХОДИТЬСЯВ РЯДУ НАПРЯЖЕНИЙ
- 17. НАПИШИТЕ УРАВНЕНИЯ ВОЗМОЖНЫХ РЕАКЦИЙK+ CuSO4Cu + Hg(NO3)2Fe + CuCl2Al + ZnSO4Zn + Al(NO3)3
- 18. ХЛОРИД ЖЕЛЕЗА(III) + НИТРАТ СЕРЕБРА= НИТРАТ КАЛИЯ+ ХЛОРИД НАТРИЯ=
- 19. ГИДРОКСИД НАТРИЯ+ СУЛЬФИД ЖЕЛЕЗА(II)=ГИДРОКСИД КАЛИЯ + СУЛЬФАТ ЖЕЛЕЗА(III) =
- 20. Химические свойства солей с + кислоты =
- 21. Скачать презентацию
- 22. Похожие презентации
Кто хочет съесть ядро ореха, должен расколоть его скорлупу плавт