- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Химическое равновесие
Содержание
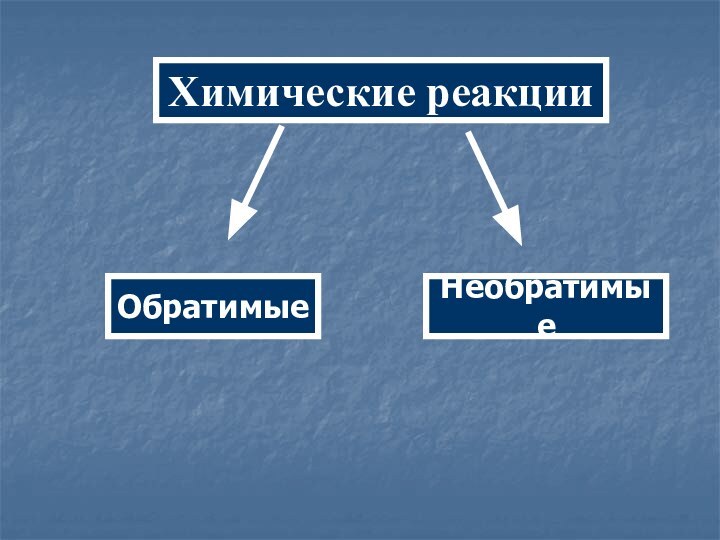
- 2. Химические реакцииОбратимыеНеобратимые
- 3. Задание 1: Написать факторы, влияющие на скорость химических реакций
- 4. Задание 2 : Написать кинетические уравнения для
- 5. Состояние системы, при котором скорость образования новых
- 6. Изменение прямой и обратной скорости реакции в процессе установления химического равновесия.VtVпр=Vобр
- 7. Равновесными концентрациями называются концентрации всех веществ системы, которые устанавливаются в ней при наступлении состояния химического равновесия
- 8. Константа равновесия – это отношение произведений концентраций продуктов реакций к произведению концентраций исходных веществ
- 9. A + B C +Dk1k2H2 + Br2 => HBr + HBrABCD300CntC,DA,BОкончание реакцииk2 => 0 K=>
- 10. K = k1:k2 = =[C]равн*[D]равн:[A]равн*[B]равн
- 11. Условия смещения химического равновесия - принцип Ле - Шателье«Бегство от насилия»
- 12. Если на систему, находящуюся в равновесии, производится
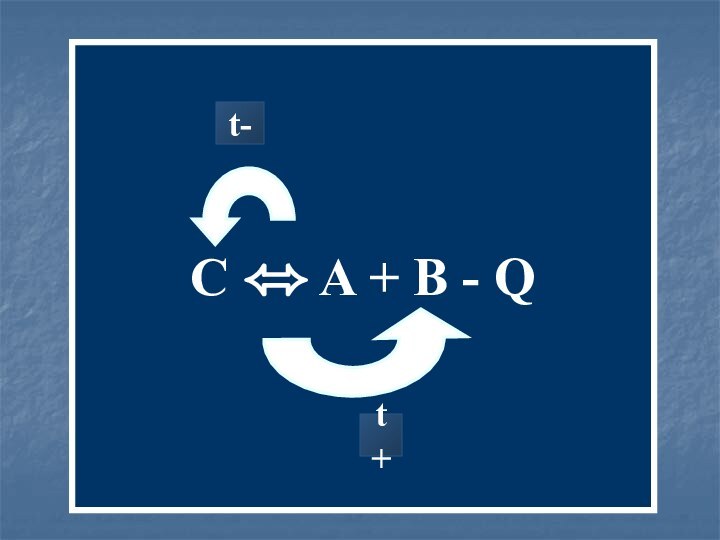
- 13. A + B C + Qt+t-
- 14. C A + B - Qt-t+
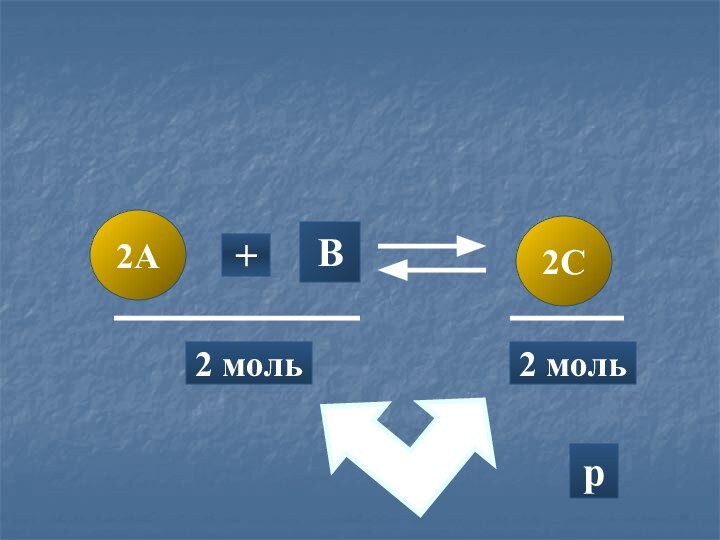
- 15. A3B2C+4 моль2 мольp-p+
- 16. 2A2C+B2 моль2 мольp
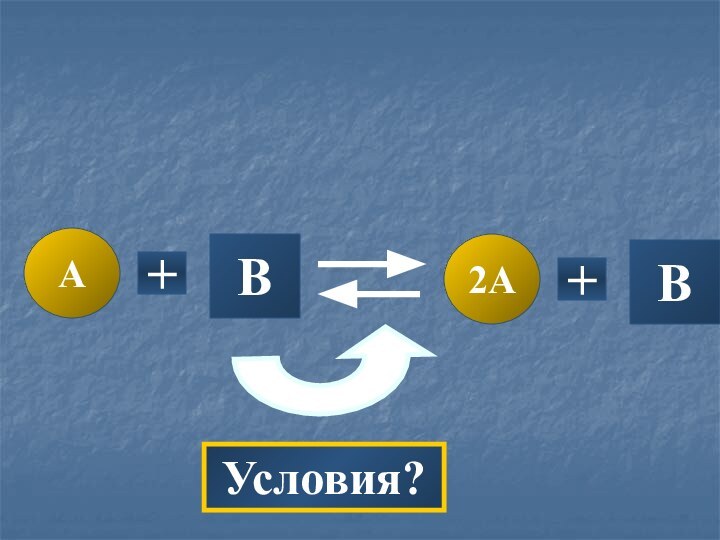
- 17. ABA+B
- 18. A2A+BB+Условия?
- 19. Скачать презентацию
- 20. Похожие презентации
Химические реакцииОбратимыеНеобратимые








![Химическое равновесие K = k1:k2 = =[C]равн*[D]равн:[A]равн*[B]равн 300CH2](/img/tmb/13/1288640/8421a457d953a656d53acaeccccb38ba-720x.jpg)






Слайд 5 Состояние системы, при котором скорость образования новых продуктов
равна скорости их превращения в исходные вещества, называется химическим
равновесием. Vпр=VобрСлайд 6 Изменение прямой и обратной скорости реакции в процессе
установления химического равновесия.
V
t
Vпр=Vобр
Слайд 7 Равновесными концентрациями называются концентрации всех веществ системы, которые
устанавливаются в ней при наступлении состояния химического равновесия
Слайд 8 Константа равновесия – это отношение произведений концентраций продуктов
реакций к произведению концентраций исходных веществ
Слайд 10
K = k1:k2 = =[C]равн*[D]равн:[A]равн*[B]равн
300C
H2 + I2 HI +
HIA B C D
t
C,D
A,B
Установление
равновесия
k1>k2; K = k1\k2 > 1
n