реторте глиняной простой. Слыву я главной кислотой... Когда сама
я растворяюсь в воде, то сильно нагреваюсь…»Серная кислота
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Email: Нажмите что бы посмотреть




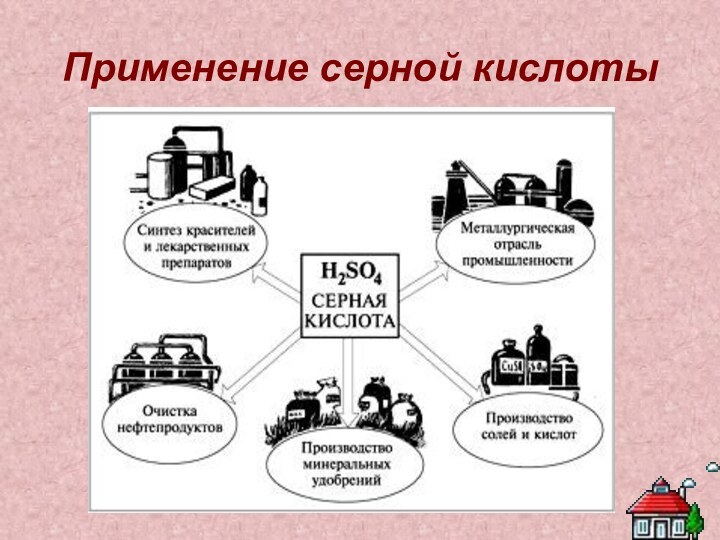
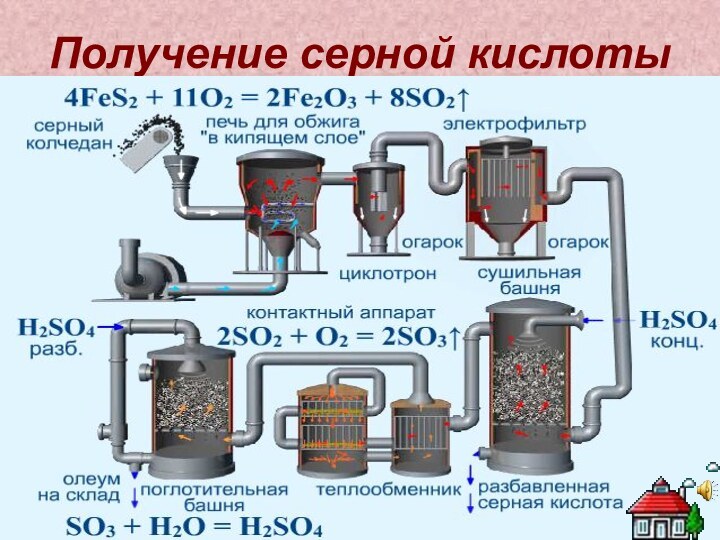








Серная кислота
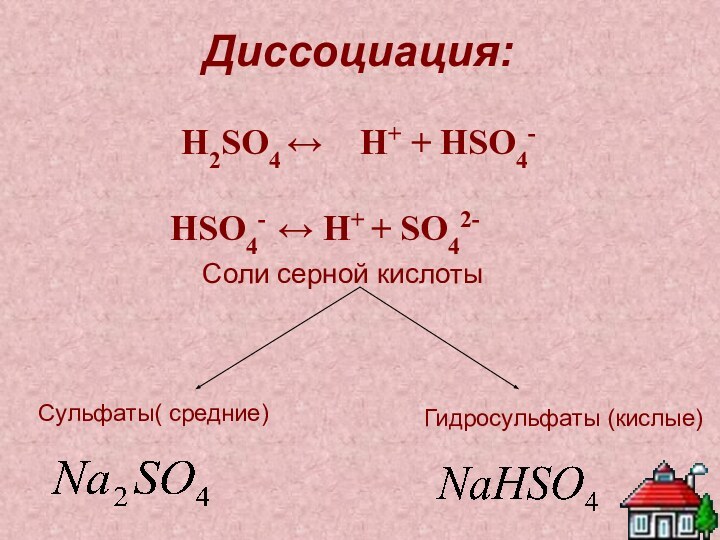
Соли серной кислоты
Сульфаты( средние)
Гидросульфаты (кислые)
!!! Помним и соблюдаем правила техники безопасности.
!!! Помним и соблюдаем правила техники безопасности.
!!! Помним и соблюдаем правила техники безопасности.
!!! Помним и соблюдаем правила техники безопасности.
Кислота + соль = соль + кислота
(если образуется осадок или газ)
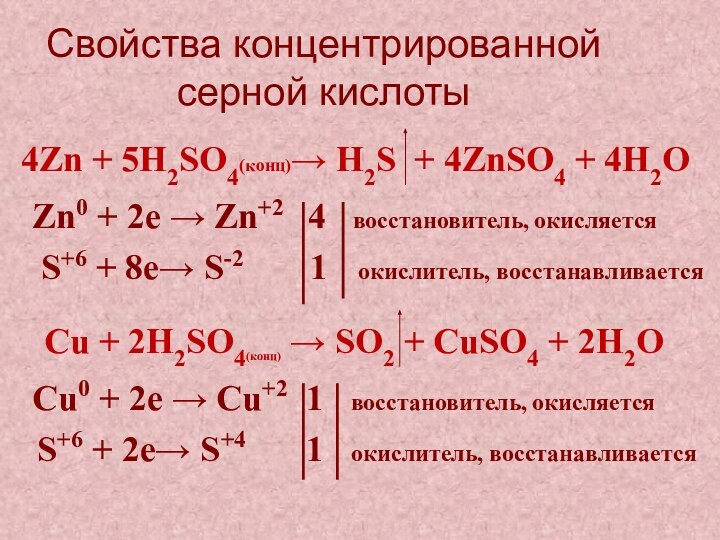
S+6 + 2е→ S+4 1 окислитель, восстанавливается
4Zn + 5H2SO4(конц)→ H2S + 4ZnSO4 + 4H2О
Zn0 + 2е → Zn+2 4 восстановитель, окисляется
S+6 + 8е→ S-2 1 окислитель, восстанавливается