хрома в периодической системе
химических элементов Д.И.Менделеева
2. Строение атома.
III.Хром
– простое вещество3. Нахождение в природе
1. Состав. Физические свойства.
2. Получение.
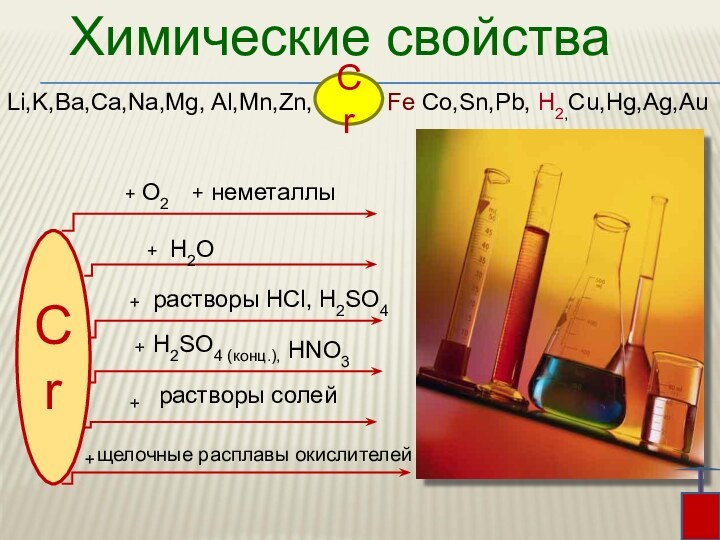
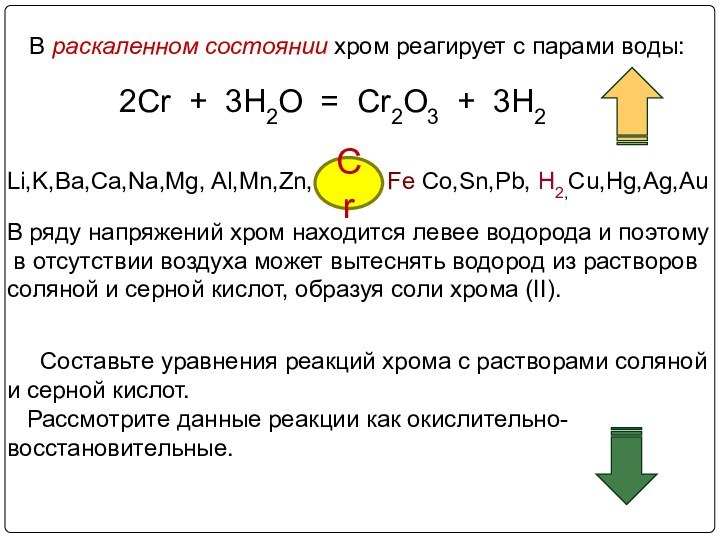
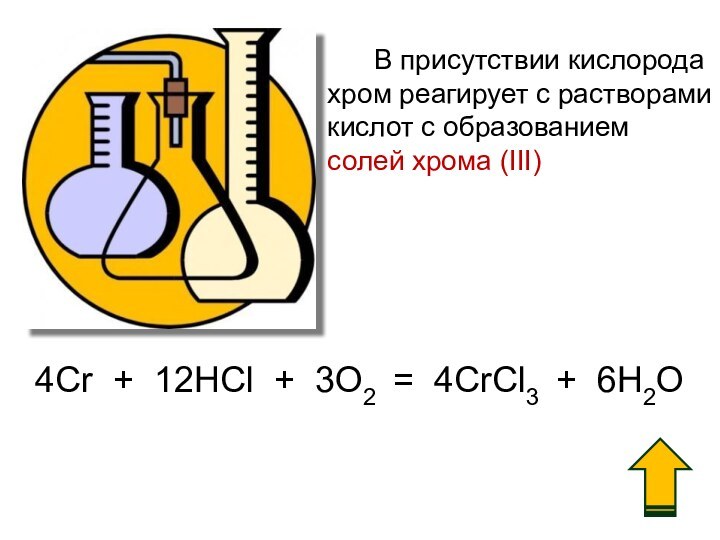
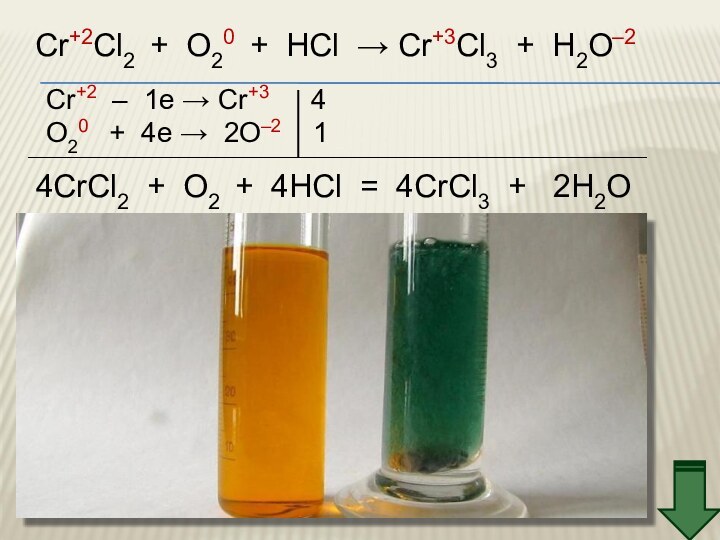
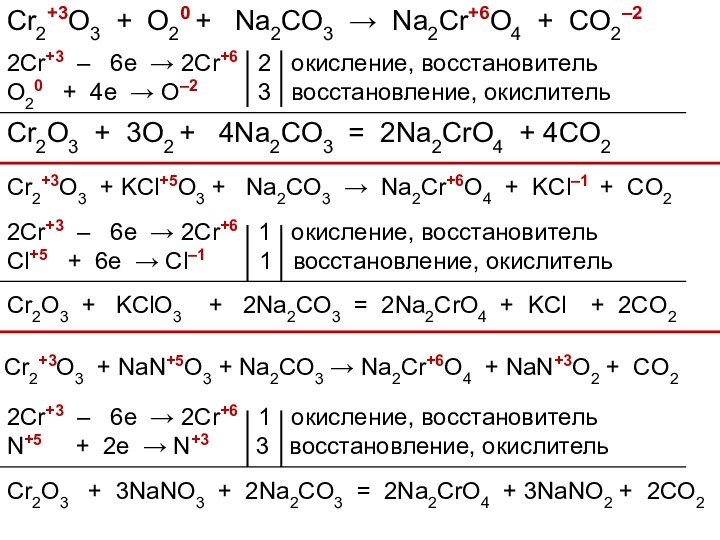
3. Химические свойства
4. Биологическая роль и физиологическое действие.
5. Применение
IV. Соединения хрома










































![Хром и его соединения Cr(OH)3 + 3NaOH = Na3[Cr(OH)6]Cr(OH)3 + 3Na+ + 3OH– = 3Na+ +](/img/tmb/15/1419515/d1856c620207865fa0854a32e1d579ef-720x.jpg)



![Хром и его соединения K3[Cr+3(OH)6] + Br20 + KOH → K2Cr+6O4 + KBr– + H2O Cr+3](/img/tmb/15/1419515/c799e43870c56a534b853806a49b8e0e-720x.jpg)











![Хром и его соединения Соединения хрома (VI) – сильные окислители Cr2O72–Cr3+Cr(OH)3[Cr(OH)6]3–H+H2OOH–Cr2O72– + 14H+ +](/img/tmb/15/1419515/08d9fd833163822104789dfc10d7df70-720x.jpg)