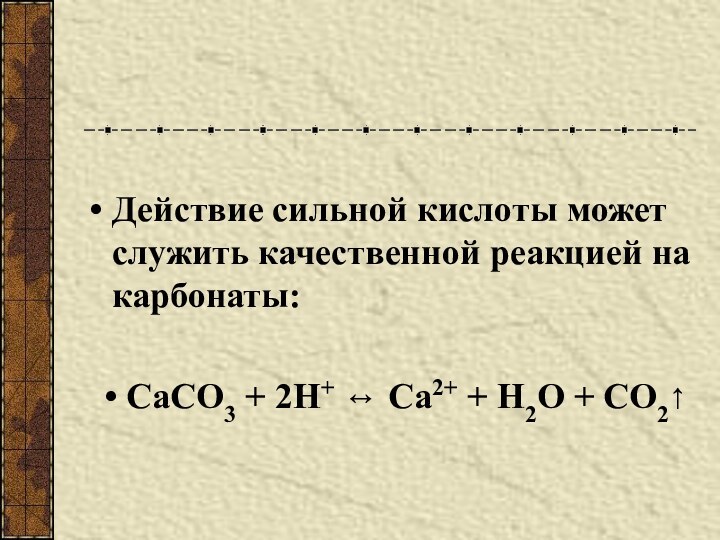
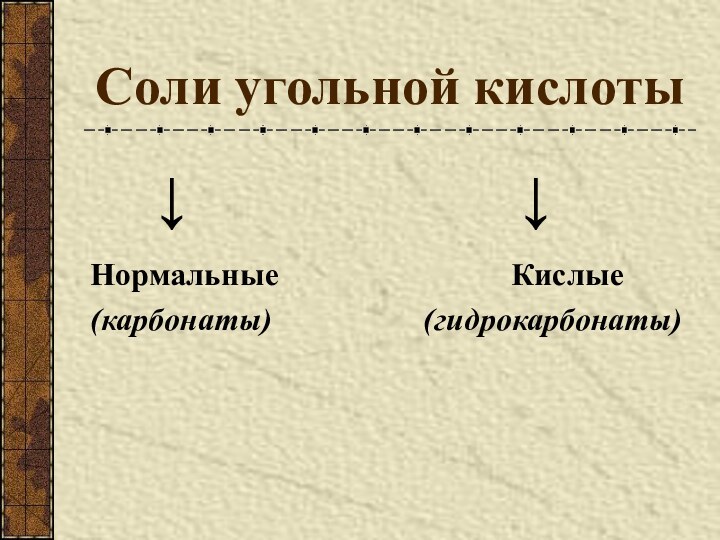
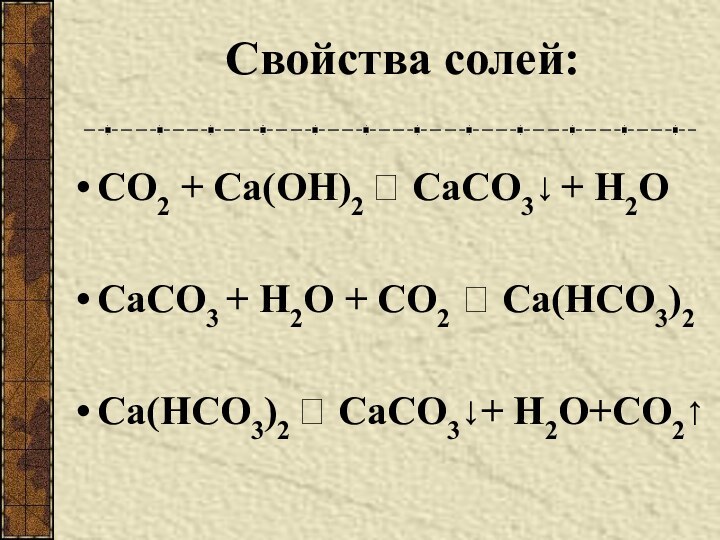
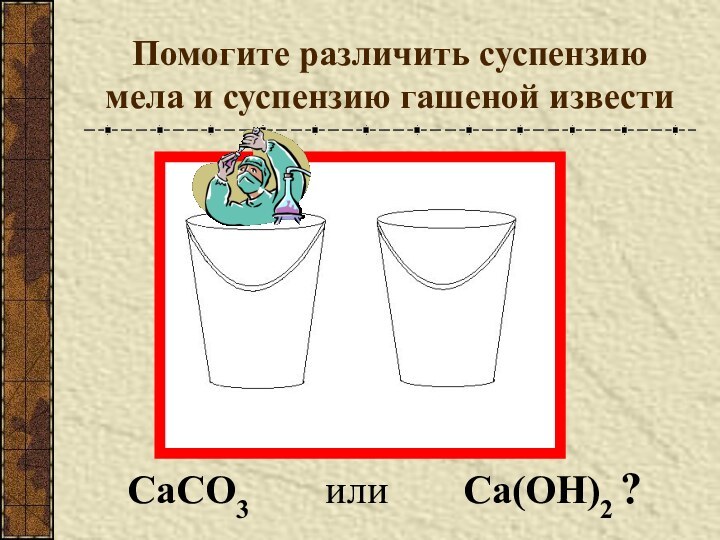
Разновидности простого вещества, образованные одним и тем же химическим
элементом?3) Количество электронов на внешней электронной оболочке элементов IV группы главной подгруппы?
4) Летучие водородные соединения углерода и кремния?
5) Формула высших оксидов элементов IVа группы?
6) Масса 0,5 моль свинца?
7) Объем 2 моль метана при н.у.?
8) Чего больше по массе в угарном газе – кислорода или углерода?
9) Степень окисления углерода в угарном и углекислом газах?
10) Где больше атомов – в 1 литре угарного или в 1 литре углекислого газах?