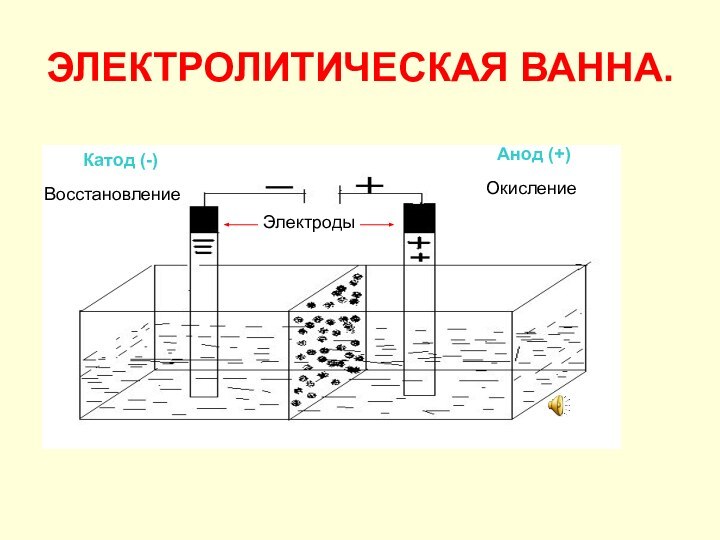
при прохождении постоянного электрического тока через расплав или раствор
электролита.Электролиты: соли, щёлочи, кислоты.
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Email: Нажмите что бы посмотреть














4) Анионы F–
Окисляются только молекулы воды
2H2O – 4ē = O2↑ + 4H+