Слайд 2
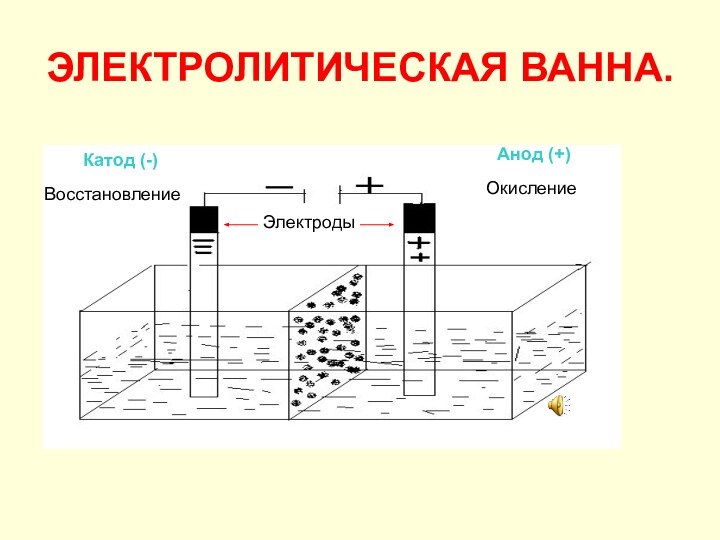
ЭЛЕКТРОЛИТИЧЕСКАЯ ВАННА.
Катод (-)
Анод (+)
Восстановление
Окисление
Электроды
Слайд 3
Электролиз.
Электролиз – окислительно-восстановительный процесс, протекающий на электродах
при прохождении постоянного электрического тока через расплав или раствор
электролита.
Электролиты: соли, щёлочи, кислоты.
Слайд 4
Процессы на катоде 1.
Катионы активных металлов:
Li+, Cs+,
Rb+, K+, Ba2+, Ca2+, Na+, Mg2+, Al3+, NH4+
Металлы не восстанавливаются, а восстанавливаются молекулы H2O:
2H2O + 2ē = H2↑ + 2OH–
Слайд 5
Процессы на катоде 2.
Катионы металлов средней активности
Mn2+, Zn2+,
Cr3+, Fe2+, Co2+, Ni2+, Sn2+, Pb2+
Катионы металлов восстанавливаются совместно
с молекулами воды:
Men++ nē = Meo
2H2O + 2ē = H2↑+ 2OH–
Слайд 6
Процессы на катоде 3.
Катионы водородаH+
Ионы H+
восстанавливаются только при электролизе растворов кислот:
2H++ 2ē =
H2↑
Слайд 7
Процессы на катоде 4.
Катионы малоактивных металлов:
Cu2+, Hg2+, Ag+,
Pt2+, Au3+
Восстанавливаются только катионы металлов:
Men++nē = Meo
Слайд 8
Процессы на аноде 1-2
1) Анионы бескислородных кислот:
I–, Br–,
S2–, Cl–
Окисляются кислотные остатки
Am– – mē = Ao
2)
Анионы OH–
Окисляются только при электролизе растворов щёлочей
4OH– – 4ē = O2↑+ 2H2O
Слайд 9
Процессы на аноде 3-4.
3) Анионы кислородсодержащих кислот:
SO42–, NO3–,
CO32–, PO43–
Окисляются молекулы воды:
2H2O – 4ē =O2↑+ 4H+
4) Анионы F–
Окисляются только молекулы воды
2H2O – 4ē = O2↑ + 4H+
Слайд 10
Если анод растворимый
Анод растворимый (активный), изготовлен из Cu,
Ag, Zn, Ni, Fe и др. металлы. Анионы не
окисляются. Окисляется сам анод:
Мео – nē = Men+
Катионы Men+ переходят в раствор. Масса анода уменьшается.
Слайд 11
Электролиз расплавов
Расплав KOH = K+ + OH–
(–) Катод:
K+ + 1ē = Ko
│х 4
(+) Анод: 4OH– – 4ē = O2↑+ 2H2O │х 1
4K++ 4OH– = O2↑ + 2H2O↑+ 4K
4KOH → 4K + O2↑ + 2H2O↑
Слайд 12
Электролиз раствора NaCl
Раствор NaCl
(–) Катод ← Na+
Cl– → (+) Анод
H2O
H2O
(–) Катод: 2H2O + 2ē = H2↑+ 2OH–
(+) Анод: 2Cl– – 2ē = Cl2↑
2H2O + 2Cl– = H2↑ + Cl2↑ + 2OH–
2H2O+2NaCl=H2↑+Cl2↑+ 2NaOH
Слайд 13
Если анод растворимый
Анод растворимый.
Электролиз раствора AgNO3
(анод растворимый
– из Ag)
(–) Катод: Ag+ + 1ē = Ago
(+) Анод: Ago – 1ē = Ag+
Ago + Ag+ = Ag+ + Ago
Электролиз сводится к переносу серебра с анода на катод.
Слайд 14
Законы электролиза.
Законы Фарадея.
Масса веществ, выделившегося на электроде при
электролизе, пропорциональна количеству электричества, прошедшее через электролит:
где , m–масса
веществ продуктов электролиза, гр.
Э – эквивалентная масса вещества, гр.
I – сила тока, А.
F – постоянная Фарадея = 96500 Кл.
t – время электролиза, сек.