Слайд 2
Тема урока:
Непредельные углеводороды
Этилен
Строение
Получение
Свойства
Применение
Слайд 3
Девиз урока:
Все познается в
сравнении
Слайд 4
Цели и задачи урока
Расширить знания об углеводородах, их
классификации, дать понятие о этиленовых углеводородах. Узнать особенности строения
алкенов, общую формулу алкенов, физические и химические свойства. Уметь записывать молекулярные, структурные, электронные формулы алкенов, уметь называть вещества по систематической номенклатуре. Уметь доказывать химические свойства алкенов, записывать уравнения реакций, сравнивать их со свойствами предельных углеводородов. Знать способы получения и области применения алкенов.
Развить познавательную и творческую деятельность, умений сравнивать и обобщать, развивать аналитические способности мышления учащихся.
Воспитать умственный труд, продолжить формирование диалектико-материалистического мировоззрения учащихся, воспитание бережного отношения к природе
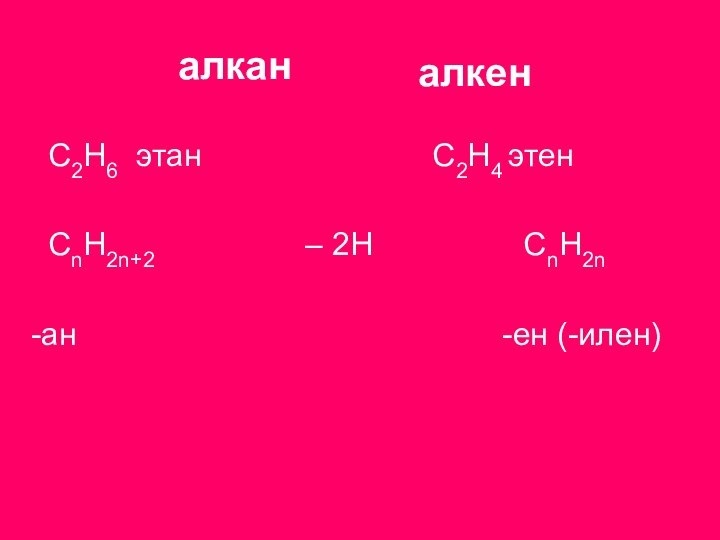
С2Н4
этен
СnН2n+2 – 2H CnH2n
-ан -ен (-илен)
алкан
алкен
Слайд 6
Физические свойства
С2-С4-Г
С5-С18-Ж
С19-Т
Слайд 7
СОСТАВИТЬ ДЛЯ ПЕНТЕНА-2 ЧЕТЫРЕ ИЗОМЕРА (ПО ОДНОМУ НА
КАЖДЫЙ ВИД)
Слайд 8
Составить для пентена-2 четыре изомера(по одному на каждый
вид)
сн3-сн=сн-сн2-сн3 пентен-2
Структурная изомерия
Изомерия углеродного скелета
сн2=с-сн2-сн3
сн3 2-метил-бутен-1
Изомерия положения кратной связи
сн2=сн-сн2-сн2-сн3 пентен-1
Слайд 9
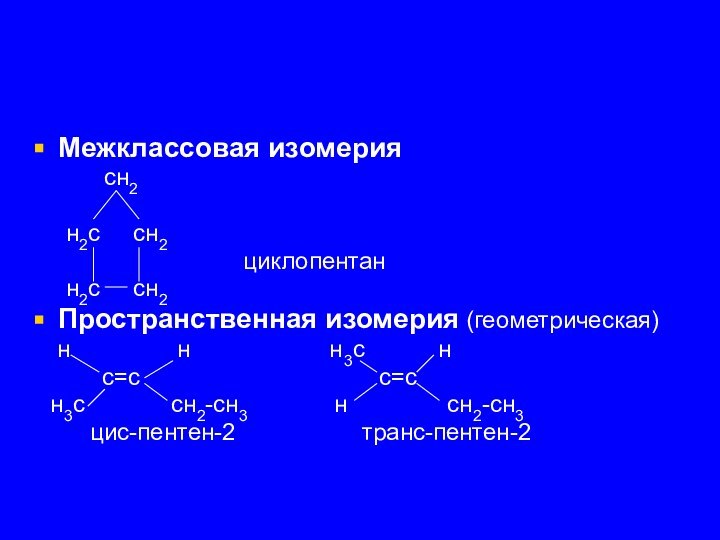
Межклассовая изомерия
сн2
н2с сн2
циклопентан
н2с сн2
Пространственная изомерия (геометрическая)
н н н3с н
с=с с=с
н3с сн2-сн3 н сн2-сн3
цис-пентен-2 транс-пентен-2
Слайд 10
Способы получения алкенов
Промышленные(крекинг алканов,дегидрирование алканов, пиролиз нефти)
Лабораторные(дегидрогалогенирование галогеналканов,
дегалогенирование дигалогеналканов, дегидратация спиртов)
Слайд 12
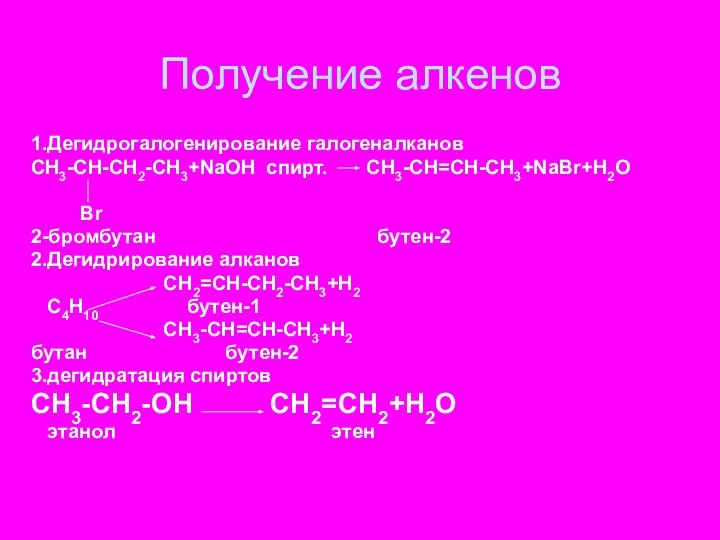
Получение алкенов
1.Дегидрогалогенирование галогеналканов
СН3-СН-СН2-СH3+NaOH спирт. CH3-CH=CH-CH3+NaBr+H2O
Br
2-бромбутан бутен-2
2.Дегидрирование алканов
СН2=СН-СН2-СН3+Н2
С4Н10 бутен-1
СН3-СН=СН-СН3+Н2
бутан бутен-2
3.дегидратация спиртов СН3-СН2-ОН СН2=СН2+Н2О
этанол этен
4.крекинг алканов С16Н34 С8Н18+С8Н16
гексадекан октан октен
5.Дегалогенирование дигалогеналканов
СН3-СН-СН-СН3+Zn СН3-СН=СН-СН3+ZnBr2
Br Br
2,3-дибромбутан бутен-2
6.Пиролиз метана 2СН4 СН2=СН2+2Н2
Слайд 13
Получение алкенов
1.Дегидрогалогенирование галогеналканов
СН3-СН-СН2-СH3+NaOH спирт. CH3-CH=CH-CH3+NaBr+H2O
Br
2-бромбутан бутен-2
2.Дегидрирование алканов
СН2=СН-СН2-СН3+Н2
С4Н10 бутен-1
СН3-СН=СН-СН3+Н2
бутан бутен-2
3.дегидратация спиртов
СН3-СН2-ОН СН2=СН2+Н2О
этанол этен
Слайд 14
Крекинг алканов
С16Н34 С8Н18+С8Н16
Дегалогенирование дигалогеналканов
СН3-СН-СН-СН3+Zn
СН3-СН=СН-СН3+ ZnВr2
Вr Вr
Пиролиз
метана
2СН4 СН2=СН2+2Н2
Слайд 15
АЛКАНЫ АЛКЕНЫ
СnН2n+2
SP³
109º28‘
0,154 НМ
Тетраэдрическое
-ан
Структурная
изомерия (Изомерия углеродного скелета)
Cn Н 2n
SP²
120º
0,134 НМ
Плоское
-ен
Структурная изомерия (изомерия
углеродного скелета, положение кратной связи, межклассовая изомерия).
Пространственная изомерия (геометрическая)
Слайд 16
физкультминутка
Раз, два, три, четыре,
Дышим глубже, машем шире…
Слайд 17
Химические свойства алкенов
Электрофильное присоединение
(гидрирование, галогенирование, гидрогалогенирование, гидратация )
Полимеризация
Окисление
(горение,
реакция Вагнера,
каталитическое окисление)
Слайд 20
Химические свойства алкенов
Реакция присоединения
1.Галогенирование (кач. Реакция на =
связь)
СН2=СН2+Br 2 CН2Br-CН2Br
Этен
1,2-дибромэтан
2.Гидрирование алкенов
СН3-СН=СН2+Н2 СН3-СН2-СН3
пропен пропан
Слайд 21
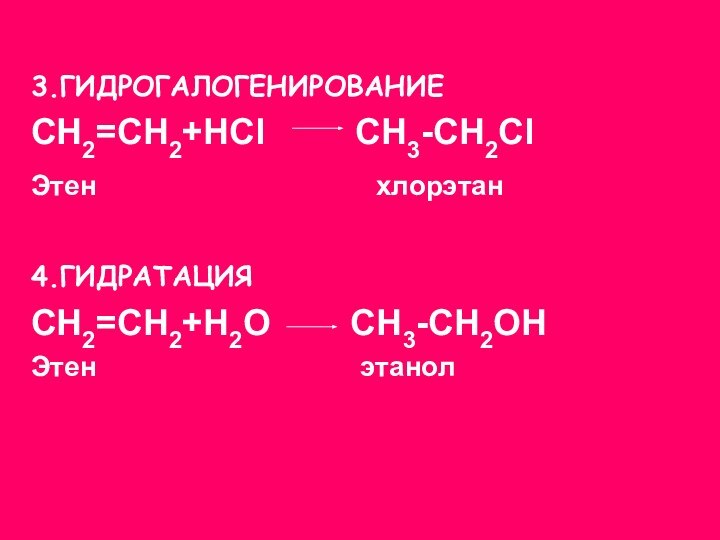
3.ГИДРОГАЛОГЕНИРОВАНИЕ
СН2=СН2+НСl СН3-СН2Сl
Этен
хлорэтан
4.ГИДРАТАЦИЯ
СН2=СН2+Н2О СН3-СН2ОН
Этен этанол
Слайд 22
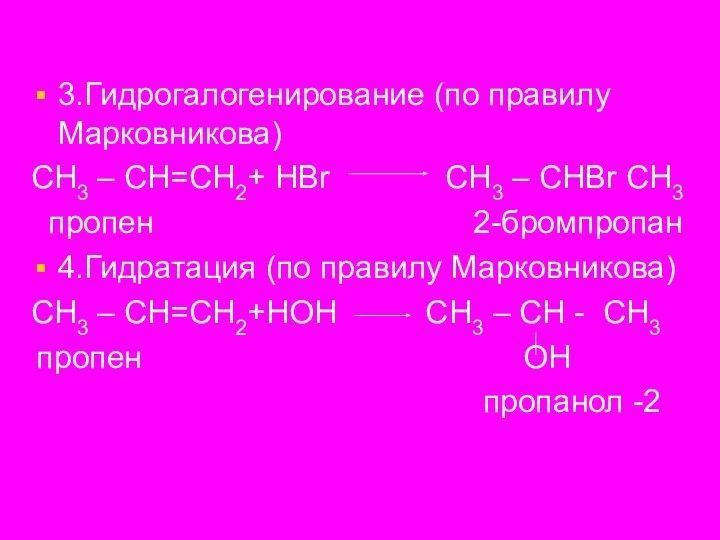
3.Гидрогалогенирование (по правилу Марковникова)
СН3 – СН=СН2+ НBr
СН3 – СНBr СН3
пропен 2-бромпропан
4.Гидратация (по правилу Марковникова)
СН3 – СН=СН2+НОН СН3 – СН - СН3
пропен ОН
пропанол -2
Слайд 23
5.Полимеризация
nCН2= CН2 (…
- СН2 - СН2 - …)n
мономер
полимер
Этилен Полиэтилен
Слайд 24
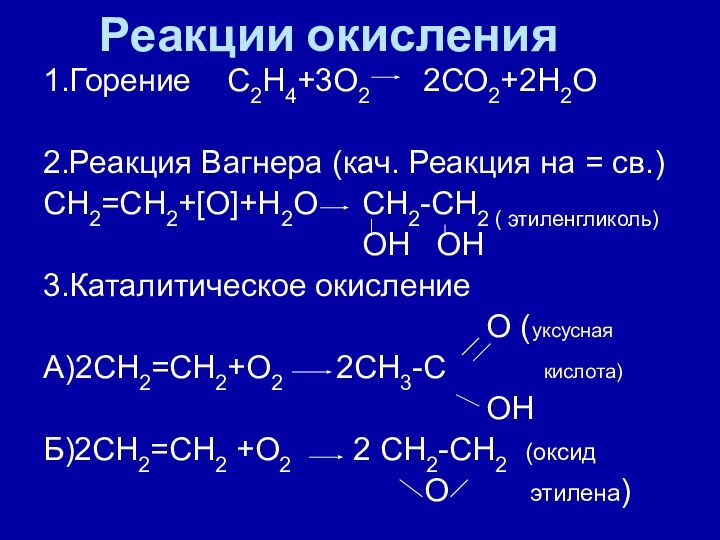
Реакции окисления
1.Горение С2Н4+3О2 2СО2+2Н2О
2.Реакция Вагнера
(кач. Реакция на = св.)
СН2=СН2+[О]+Н2О СН2-СН2 (
этиленгликоль)
ОН ОН
3.Каталитическое окисление
О (уксусная
А)2СН2=СН2+О2 2СН3-С кислота)
ОН
Б)2СН2=СН2 +О2 2 СН2-СН2 (оксид
О этилена)
Слайд 25
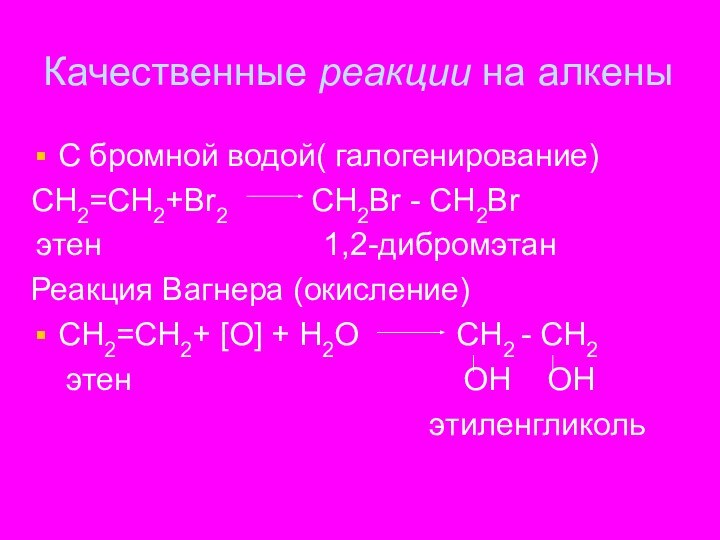
Качественные реакции на алкены
С бромной водой( галогенирование)
СН2=СН2+Вr2
СН2Br - СН2Br
этен 1,2-дибромэтан
Реакция Вагнера (окисление)
СН2=СН2+ [О] + Н2О СН2 - СН2
этен ОН ОН
этиленгликоль
свойства
применение
Причинно-следственная связь
Слайд 27
АЛКАНЫ АЛКЕНЫ
СnН2n+2
SP³
109º28‘
0,154 НМ
Тетраэдрическое
-ан
Структурная
изомерия (Изомерия углеродного скелета)
Реакции окисления (горения)
Реакции замещения
Реакции дегидрирования
Cn Н
2n
SP²
120º
0,134 НМ
Плоское
-ен
Структурная изомерия (изомерия углеродного скелета, положение кратной связи, межклассовая изомерия).
Пространственная изомерия (геометрическая)
Реакции окисления (горения, каталитическое окисление, реакция Вагнера)
Реакции присоединения (гидрирование, галогенирование, гидрогалогенирование, гидратация) Реакции полимеризации
Реакции дегидрирования
Слайд 28
Применение этилена
Этанол (бутадиен-1,3; уксусная кислота)
Дихлорэтан (хлорвинил,эиленгликоль)
Стирол (полистирол)
Оксид этилена
(полиэтилен)
Слайд 29
Применение пропилена
Полипропилен
Ацетон
Глицерин
Полиакрилонитрил
Кумол(фенол)
? C3H8
C2H4CI2
Закрепление
Осуществите превращения:
Слайд 31
С2Н4+НСl С2Н5Сl (гидрогалогенирование)
хлорэтан
С2Н4+Н2
С2Н6 (гидрирование)
этан
С2Н4+Сl2 С2Н4Сl2
1,2- дихлорэтан
С2Н6 + CI2 С2Н5CI+НCI
хлорэтан
C2Н5СI+СН3CI+2Na С3Н8+NaCI (р. Вюрца)
пропан