- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Строение вещества
Содержание
- 2. АТОМЫ И ЭЛЕМЕНТЫОкружающий нас мир состоит из
- 3. ХИМИЧЕСКИЕ ЭЛЕМЕНТЫВ настоящее время известно более 114
- 4. СИМВОЛЫ (ЗНАКИ) ЭЛЕМЕНТОВХимические знаки современного вида были предложены шведским химиком Й. Я.Берцелиусом в 1813 году
- 5. ПЕРИОДИЧЕСКАЯ СИСТЕМАВ настоящее время общепринятой является короткопериодная
- 6. ПЕРИОДИЧЕСКАЯ СИСТЕМАВертикальные столбцы называют группами. Их восемь.
- 7. МЕТАЛЛЫ И НЕМЕТАЛЛЫ
- 8. Если от элемента бора (В) провести условную
- 9. СТРОЕНИЕ АТОМААтомы имеют сложное строение: вокруг положительно
- 10. ЭЛЕКТРОННЫЕ ОРБИТАЛИ
- 11. ФОРМУЛЫ АТОМОВВ современной химии строение атомов принято
- 12. ФОРМУЛЫ АТОМОВНа таких формулах квадратом обозначается электронная
- 13. ПОЛОЖЕНИЕ В СИСТЕМЕПо положению в Системе можно
- 14. ХАРАКТЕРИСТИКИ ЭЛЕМЕНТАХимический элемент можно характеризовать по следующим
- 15. ВЗАИМОДЕЙСТВИЯ АТОМОВДля атомов присуще стремление приобрести более
- 16. ХИМИЧЕСКИЕ СВЯЗИВозможны 4 случая взаимодействия атомов:Металл А
- 17. ИОННАЯ И МЕТАЛЛИЧЕСКАЯ СВЯЗИАтомы металлов очень слабо
- 18. КОВАЛЕНТНЫЕ СВЯЗИ
- 19. ОБРАЗОВАНИЕ КОВАЛЕНТНОЙ СВЯЗИКовалентная связь формируется между атомами
- 20. ВИДЫ КОВАЛЕНТНЫХ СВЯЗЕЙОни могут быть неполярными, полярными,
- 21. СОСТОЯНИЕ ВЕЩЕСТВАЧастицы вещества находятся в непрестанном хаотическом
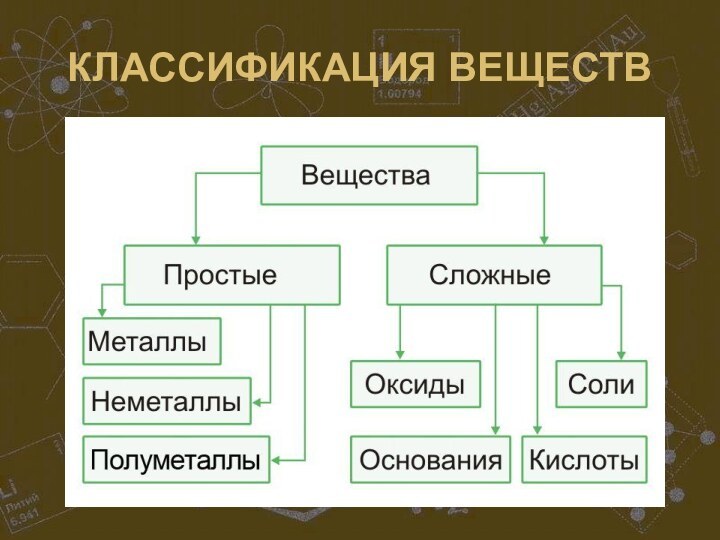
- 22. КЛАССИФИКАЦИЯ ВЕЩЕСТВ
- 23. ПРОСТЫЕ ВЕЩЕСТВА-МЕТАЛЛЫЗолотоСеребро
- 24. ПРОСТЫЕ ВЕЩЕСТВА-НЕМЕТАЛЛЫУглеродСера
- 25. БИНАРНЫЕ СОЕДИНЕНИЯПримером бинарных (состоящих из двух элементов) соединений являются оксиды. Здесь приведена их классификация:
- 26. ХАРАКТЕРИСТИКА ВЕЩЕСТВАЛюбое вещество можно характеризовать его физическими
- 27. Mr и МОЛЯРНАЯ МАССАМолярная масса веществ с
- 28. Скачать презентацию
- 29. Похожие презентации
АТОМЫ И ЭЛЕМЕНТЫОкружающий нас мир состоит из веществ, а вещества образованы мельчайшими частицами: кристаллами, молекулами и атомами. При этом наименьшими структурными частицами веществ являются молекулы (у молекулярных веществ) или кристаллы (атомные либо ионные). Из атомов же























Слайд 3
ХИМИЧЕСКИЕ ЭЛЕМЕНТЫ
В настоящее время известно более 114 химических
элементов, но устойчивыми являются только 83 элемента, остальные либо
не существуют в природе (поэтому их получают путём радиоактивного синтеза), либо естественно радиоактивны, то есть самопроизвольно превращаются в другие химические элементы с излучением энергии и элементарных частиц. Данные о химических элементах собраны в Периодической системе Д.И.Менделеева (1869 год).
Слайд 4
СИМВОЛЫ (ЗНАКИ) ЭЛЕМЕНТОВ
Химические знаки современного вида были предложены
шведским химиком Й. Я.Берцелиусом в 1813 году
Слайд 5
ПЕРИОДИЧЕСКАЯ СИСТЕМА
В настоящее время общепринятой является короткопериодная форма
Периодической системы. Все элементы расположены в порядке возрастания атомной
массы. Горизонтальные строки, в которых у атомов происходит образование устойчивого внешнего электронного слоя, называются периодами. Периодов всего семь: 3 периода - малые и 4 - большие, причём последний ещё не завершён. В периодах слева направо закономерно уменьшается радиус атома, ослабевают металлические и усиливаются неметаллические свойства элемента, возрастает его электроотрицательность (χ)
Слайд 6
ПЕРИОДИЧЕСКАЯ СИСТЕМА
Вертикальные столбцы называют группами. Их восемь. Группы
содержат элементы с одинаковой высшей степенью окисления. Группы подразделены
на подгруппы. Если в подгруппе есть элементы малых и больших периодов, то эта подгруппа главная – подгруппа «А». Если в подгруппе находятся элементы только больших периодов, тогда эта подгруппа называется побочной или подгруппой «Б». В группе сверху вниз закономерно увеличивается радиус атомов и усиливаются металлические свойства элементов.Слайд 8 Если от элемента бора (В) провести условную линию
к элементу астату (At), то в главных подгруппах окажутся:
правее и выше линии «B – At» – неметаллы; левее и ниже – металлы. Элементы, оказавшиеся вблизи этой линии проявляют переходные свойства. Неметаллов, включая благородные газы, насчитывается 22, все остальные элементы, в том числе и вновь синтезируемые, относятся к металлам. В побочных подгруппах находятся только металлы. Для металлов характерно небольшое число электронов на внешнем энергетическом уровне (1-3) и электроотрицательность ниже 2. Неметаллам присуща высокая электроотрицательность, 4 и более электронов на внешнем уровне. При образовании химических связей атомы металлов отдают внешние электроны, а атомы неметаллов их захватывают.
Слайд 9
СТРОЕНИЕ АТОМА
Атомы имеют сложное строение: вокруг положительно заряженного
массивного ядра движутся по определённым орбитам с огромной скоростью
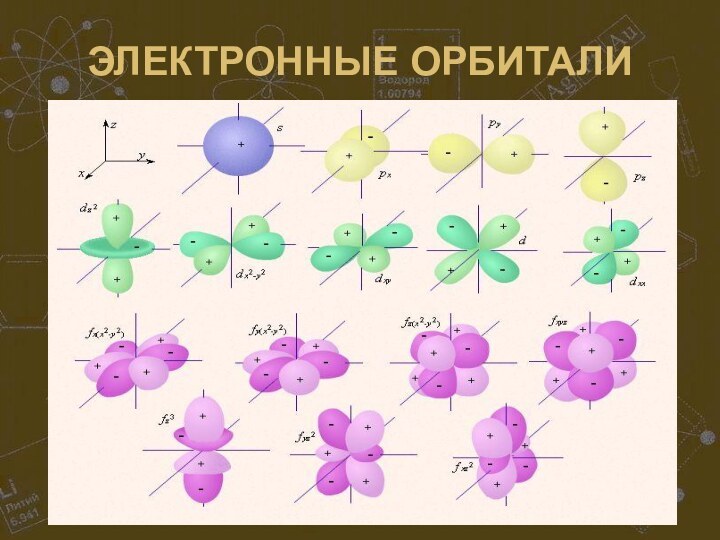
практически невесомые отрицательно заряженные электроны. Ядро состоит из нуклонов – протонов(+) и нейтронов(0). По форме орбиты электроны бывают 4 типов: s, p, d и f и образуют электронные облака (орбитали) 4 видов. Общее число электронов в атоме равно числу протонов в ядре, а число электронов на внешнем уровне (у элементов главных подгрупп) равно номеру группы. Число энергетических уровней (электронных слоёв) в атоме равно номеру периода.
Слайд 11
ФОРМУЛЫ АТОМОВ
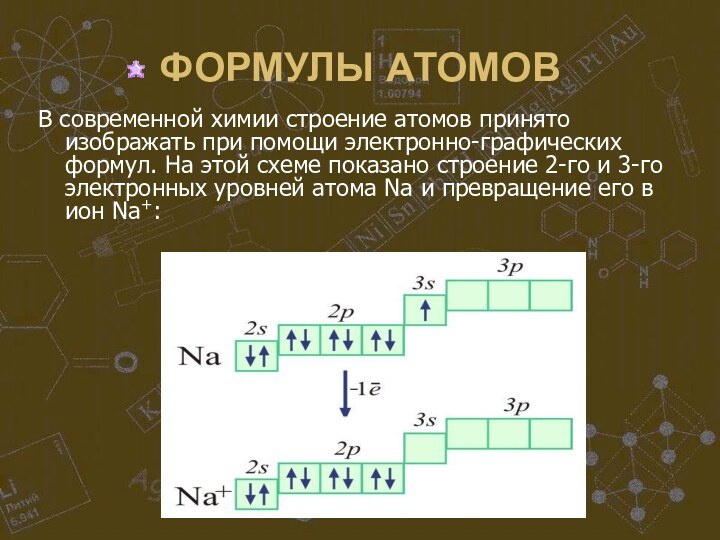
В современной химии строение атомов принято изображать
при помощи электронно-графических формул. На этой схеме показано строение
2-го и 3-го электронных уровней атома Na и превращение его в ион Na+:
Слайд 12
ФОРМУЛЫ АТОМОВ
На таких формулах квадратом обозначается электронная орбиталь,
стрелки внутри квадрата символизируют электроны, этажное расположение обозначает уровни
и подуровни электронов. Графическая часть формулы подтверждается буквенно-цифровым обозначением. Отсюда их название: электронно-графические формулы.
Слайд 13
ПОЛОЖЕНИЕ В СИСТЕМЕ
По положению в Системе можно определить:
Заряд
ядра, число протонов в ядре и общее число электронов
= порядковый номер элемента;Число энергетических уровней (электронных оболочек) = номер периода;
Число электронов на внешнем уровне у элементов главных подгрупп = номер группы;
Металл или неметалл – по расположению относительно линии «B-At».
Слайд 14
ХАРАКТЕРИСТИКИ ЭЛЕМЕНТА
Химический элемент можно характеризовать по следующим пунктам:
Положение
в Периодической системе;
Металл или неметалл;
Электроотрицательность, то есть сила притяжения
электронов к ядру;Степень окисления, то есть число отданных или захваченных в процессе образования данного вещества, электронов (применяется к любым химическим элементам);
Валентность, то есть число образованных в данном веществе общих пар электронов (корректнее применять эту характеристику только к неметаллам).
Слайд 15
ВЗАИМОДЕЙСТВИЯ АТОМОВ
Для атомов присуще стремление приобрести более устойчивую
и энергетически выгодную электронную конфигурацию, характерную для благородных газов
(завершённый внешний энергетический уровень – «электронный октет»). В результате взаимодействия между собой, атомы более электроотрицательных элементов захватывают электроны на внешний уровень, а атомы менее электроотрицательных элементов – отдают свои внешние электроны.
Слайд 16
ХИМИЧЕСКИЕ СВЯЗИ
Возможны 4 случая взаимодействия атомов:
Металл А –
металл А, оба слабо удерживают внешние электроны, - образуется
металлическая связь;Металл А (отдаёт электроны) – неметалл В (захватывает электроны), образуются положительные и отрицательные ионы, а между ними ионная связь;
Неметалл В – неметалл С (электронные пары подтягивает к себе более электроотрицательный неметалл, образуется полярная ковалентная связь);
Неметалл В – неметалл В (электронные пары расположены строго посередине, так как электроотрицательность обоих атомов одинакова, образуется неполярная ковалентная связь).
Слайд 17
ИОННАЯ И МЕТАЛЛИЧЕСКАЯ СВЯЗИ
Атомы металлов очень слабо удерживают
свои внешние электроны и в кристалле металла наряду с
нейтральными атомами всегда присутствуют положительные ионы и свободно движущиеся электроны – «электронный газ». С этим связаны все типичные свойства простых веществ металлов: электропроводность, высокая теплопроводность, металлический блеск и ковкость. Таким образом, металлическая связь похожа на ионную, а свойства металлов - на свойства ионных веществ.
Слайд 19
ОБРАЗОВАНИЕ КОВАЛЕНТНОЙ СВЯЗИ
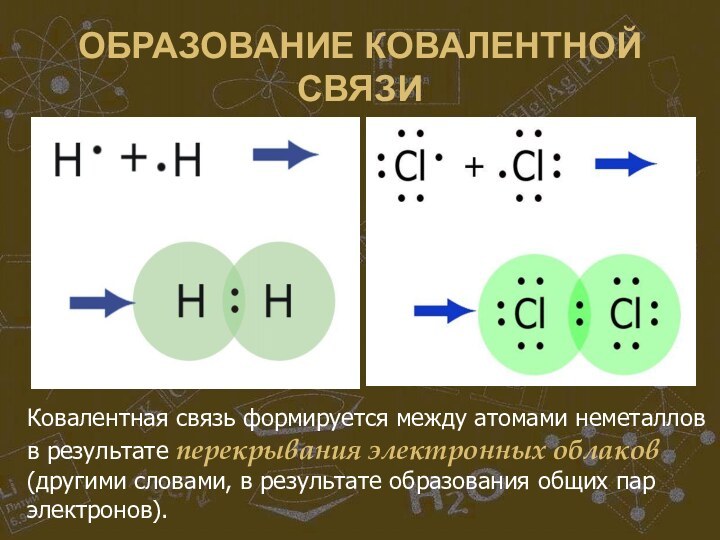
Ковалентная связь формируется между атомами неметаллов
в результате перекрывания электронных облаков (другими словами, в результате
образования общих пар электронов).
Слайд 20
ВИДЫ КОВАЛЕНТНЫХ СВЯЗЕЙ
Они могут быть неполярными, полярными, одинарными,
двойными и тройными. Двойные и тройные называются кратными
Слайд 21
СОСТОЯНИЕ ВЕЩЕСТВА
Частицы вещества находятся в непрестанном хаотическом движении,
при повышении температуры колебания частиц усиливаются, а при понижении
– замедляются. Соответственно существуют 3 агрегатных состояния веществ:Твёрдое;
Жидкое;
Газообразное.
Слайд 25
БИНАРНЫЕ СОЕДИНЕНИЯ
Примером бинарных (состоящих из двух элементов) соединений
являются оксиды. Здесь приведена их классификация:
Слайд 26
ХАРАКТЕРИСТИКА ВЕЩЕСТВА
Любое вещество можно характеризовать его физическими и
химическими свойствами: цветом, запахом, массой, плотностью, объёмом, критическими температурами,
отношением к другим веществам. Специально для характеристики веществ введена величина, именуемая «количество вещества». Она обозначается как латинская «n» или греческая «ν(ню)» и измеряется в молях:
Слайд 27
Mr и МОЛЯРНАЯ МАССА
Молярная масса веществ с атомным
строением (или записываемых как атомные: Cu, Fe, Au, C,
S, P, Ne, Xe…) численно равняется их атомной массе Ar. Молярная масса остальных веществ численно равна их относительной молекулярной массе Mr.M = Ar (г/моль ) и M = Mr (г/моль)





























