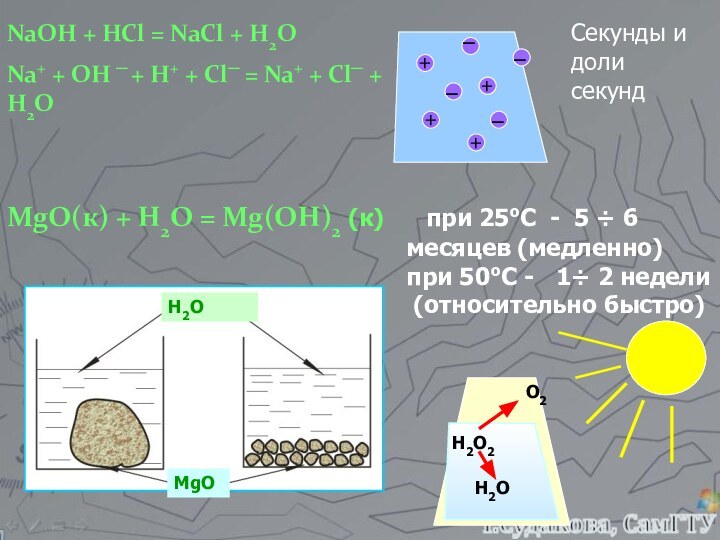
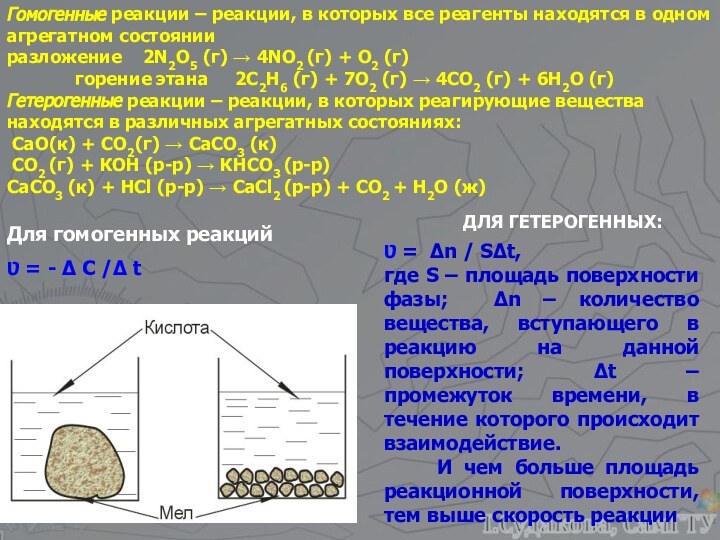
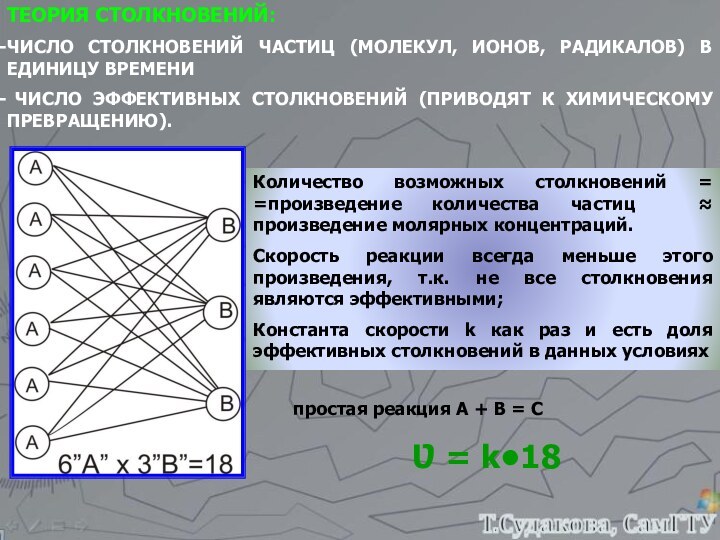
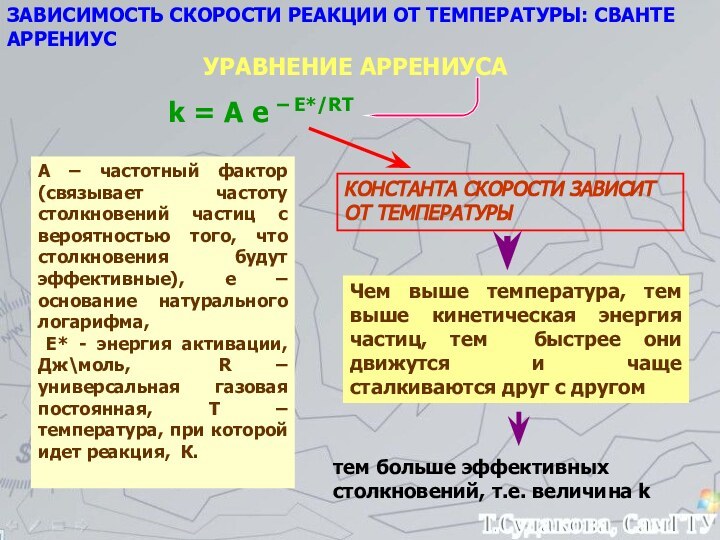
а, b, c, d – стехиометрические коэффициенты реагентов и
продуктов соответственно. В замкнутом постоянном объеме реагенты А и В будут исчезать со скоростью
Ʋ = - Δ СA / Δ t и Ʋ = - Δ СВ/ Δ t,
а продукты С и D будут накапливаться со скоростью
Ʋ = Δ СС / Δ t и Ʋ = Δ СD / Δ t.
Δ – изменение, t – время, СA, СВ, СС, СD – молярные концентрации веществ, моль/л, знак минус в этих уравнениях означает уменьшение концентрации,
скорость реакции можно выразить по любому реагенту или продукту:
Ʋ = - Δ СА /Δ t = - Δ СВ /Δ t = Δ СС/ Δ t = Δ СD / Δ t, моль/л•с
Скорость химической реакции – изменение концентрации исходных реагентов или продуктов за единицу времени: