- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Классификация химических реакций
Содержание
- 2. Пособие составила: учитель химииЛюдмила Александровна Гапиенко. (Электронное пособие для учителей и учащихся средней школы)Классификацияхимических реакций
- 3. Химические реакции,- это процессы, в результате которых
- 4. ОбменаЗамещениеПо числу и составу исходных веществ РазложениеСоединение
- 5. Реакции соединенияРеакции соединения – это реакции в
- 6. Реакция разложения – это реакция в результате
- 7. Реакции замещенияFe + CuSO4 = FeSO4 +
- 8. Реакции обменаРеакции обмена – это реакции
- 9. По признаку обратимости все реакции делятся на:ОбратимыеОбратимыми
- 10. По тепловому эффекту все реакции делятся на:Эндотермическиереакции,
- 11. По изменению степени окисления реагирующих веществ все
- 12. Гомогенные Реакции, где реагирующие вещества и
- 13. По использованию катализатораI. Каталитические реакции, идущие с участием
- 14. Характеристика химической реакцииC + O2 = CO2 + 393,5 кДжЭто реакция:СоединенияЭкзотермическаяНеобратимаяОкислительно-восстановительная
- 15. Использованные источникиГабриелян О.С. Химия. 8 класс: Учеб.
- 16. Скачать презентацию
- 17. Похожие презентации















Слайд 2
Пособие составила:
учитель химии
Людмила Александровна Гапиенко.
(Электронное пособие
для учителей и учащихся средней школы)
Слайд 3 Химические реакции,- это процессы, в результате которых из
одних веществ образуются другие, отличающиеся от них по составу
и строениюПри химических реакциях обязательно происходит процесс изменения веществ, при котором рвутся старые и образуются новые связи между атомами.
Классификация химических реакций многопланова, то есть в ее основу могут быть положены различные признаки. Но под любой из таких признаков могут быть отнесены реакции как между неорганическими, так и между органическими веществами.
Рассмотрим классификацию химических реакций по различным признакам.
Слайд 5
Реакции соединения
Реакции соединения – это реакции в результате
которых из двух или больше веществ образуется одно новое
веществоS + O2 = SO2
BaO + H2O = Ba(OH)2
4NO2 + O2 + 2H2O = 4HNO3
Слайд 6 Реакция разложения – это реакция в результате которых
из одного вещества образуется несколько новых веществ
CaCO3 = CaO
+ CO22AgNO3 = Ag2O + 2NO2 + O2
Реакция разложения
Слайд 7
Реакции замещения
Fe + CuSO4 = FeSO4 + Cu
Zn
+ 2HCl = ZnCl2 + H2
Cl2 + 2KI =
2KCl + I2Реакции замещения – это реакции между простыми и сложными веществами, в результате которых происходит замещение атомов одного из элементов сложного вещества
Слайд 8
Реакции обмена
Реакции обмена –
это реакции между
двумя сложными веществами, в результате которых их молекулы обмениваются
своими составными частями и образуются два новых сложных веществаKOH + HBr = KBr + HOH
AgNO3 + KI = KNO3 + AgI
AlCl3 + 3KOH = 3KCl+ Al(OH)3
Слайд 9
По признаку обратимости все реакции делятся на:
Обратимые
Обратимыми называются
реакции, которые протекают в двух противоположных направлениях одновременно
N2
+ 3H2 2NH3Необратимые
Необратимыми называются реакции, протекающие в одном направлении практически до конца
HCl + KOH = KCl + HOH
Слайд 10
По тепловому эффекту все реакции делятся на:
Эндотермические
реакции, протекающие
с поглощением тепла
∆H 0, Q 0
CaCO3 CaO + CO2
∆H = +180 кДж или
Q = -180 кДж
Экзотермические
реакции,
протекающие с выделением тепла
∆H 0, Q 0
C + O2 CO2
∆H =- 393,5 кДж
Q = + 393,5 кДж
Слайд 11 По изменению степени окисления реагирующих веществ все реакции
делятся на:
Реакции, протекающие без изменения степени окисления (это все
реакции обмена и многие реакции соединения и разложения)HNO3 + Ca(OH)2 Ca(NO3)2 + H2O
2NH3 + CO2 (NH2)2CO + H2O
Mg(OH)2 MgO + H2O
Реакции окислительно-восстановительные (идут с изменением степеней окисления)
2KMn+7O-24 K2Mn+6O4 + Mn+4O2 + O02
Слайд 12
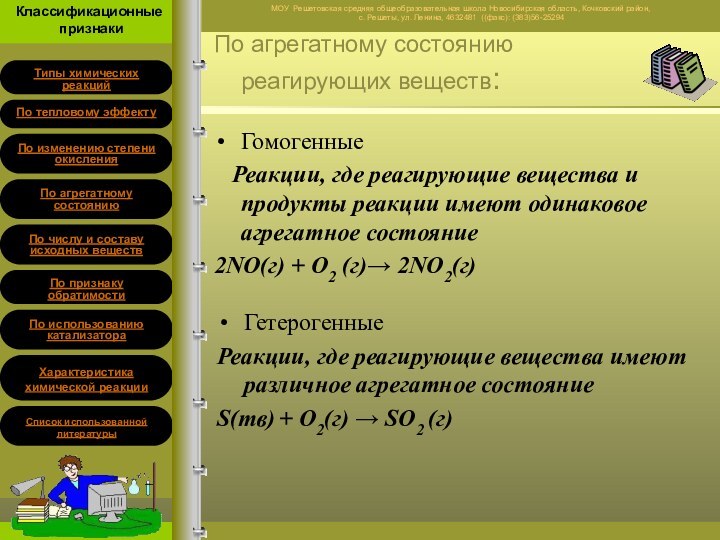
Гомогенные
Реакции, где реагирующие вещества и продукты
реакции имеют одинаковое агрегатное состояние
2NO(г) + O2 (г) 2NO2(г)
Гетерогенные
Реакции,
где реагирующие вещества имеют различное агрегатное состояниеS(тв) + O2(г) SO2 (г)
По агрегатному состоянию реагирующих веществ:
Слайд 13
По использованию катализатора
I. Каталитические реакции, идущие с участием катализатора:
3Аl
+ 3J2.
2 Аl J3C2H5OH H2SO4 CH2= CH2 + H2O
Некаталитические реакции, идущие без участия катализатора:
2Na + 2H2O 2NaOH + H2
C2H4 + 3O2 2CO2 + 2H2O
Так как все биохимические реакции, протекающие в клетках живых организмов, идут c участием особых биологических катализаторов белковой природы – ферментов, все они относятся к каталитическим или, точнее, ферментативным.
Следует отметить, что более 70% химических производств используют катализаторы.
t
t
КАТ.
H2O
Слайд 14
Характеристика химической реакции
C + O2 = CO2 +
393,5 кДж
Это реакция:
Соединения
Экзотермическая
Необратимая
Окислительно-восстановительная
Слайд 15
Использованные источники
Габриелян О.С. Химия. 8 класс: Учеб. для
общеобразоват.учебн. заведений.-М.: Дрофа,
Качалова Г.С. Алейникова О.А. Методика преподавания
химии в школе. Видеозаписи лабораторных химических опытов, иллюстрации. (Рег. Свид. №2943-1). г. Новосибирск .обл. центр информац. ТехнологийКачалова Г.С., А. М. Ким, Л. Л. Куулар. Химия-8. Учебно-методический комплекс по курсу химии для 8 класса. Новосибирск: Сиб.унив. изд-во, 2002
Качалова Г.С. Алейникова О.А. Методика преподавания химии в школе. Видеозаписи лабораторных химических опытов, иллюстрации. (Рег. Свид. №2943-1). г. Новосибирск .обл. центр информац. технологий.