X + Y → R – Y + X
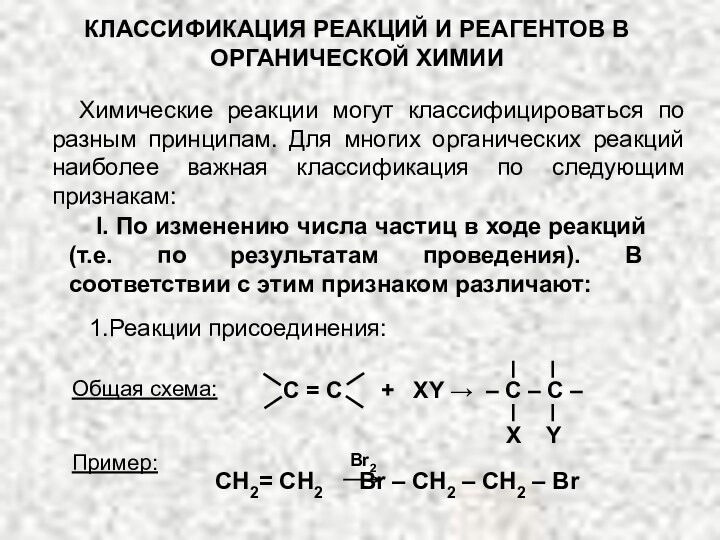
Общая
схема:Общая схема:
2. Реакции замещения:
Пример:
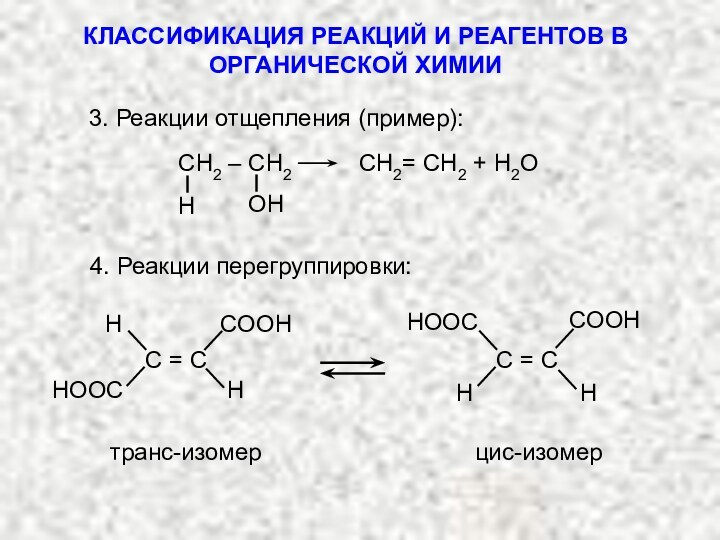
3. Реакции отщепления (элиминирования):
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Email: Нажмите что бы посмотреть



















Общая схема:
2. Реакции замещения:
Пример:
3. Реакции отщепления (элиминирования):
КЛАССИФИКАЦИЯ РЕАКЦИЙ
I. ПО ИЗМЕНЕНИЮ ЧИСЛА ЧАСТИЦ В ХОДЕ РЕАКЦИЙ
Примечание
ТИПЫ РЕАГЕНТОВ
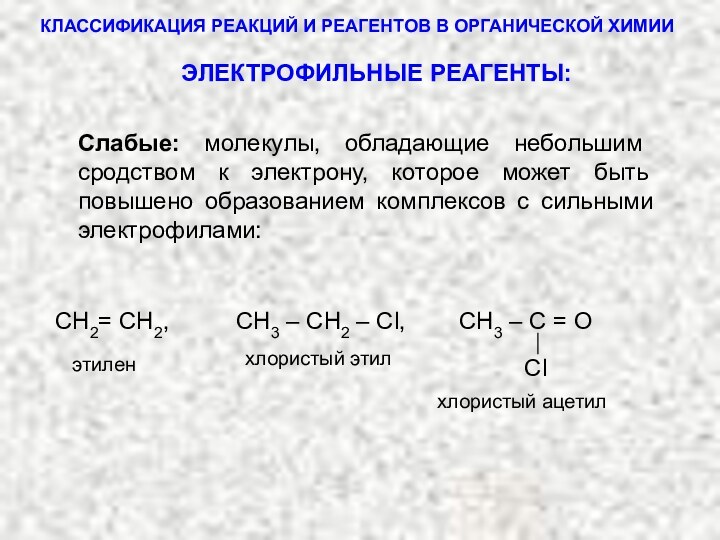
К ним относятся заряженные частицы (катионы) или нейтральные частицы, обладающие повышенным сродством к электрону.
1. ЭЛЕКТРОФИЛЬНЫЕ РЕАГЕНТЫ
хлористый ацетил
этилен
хлористый этил
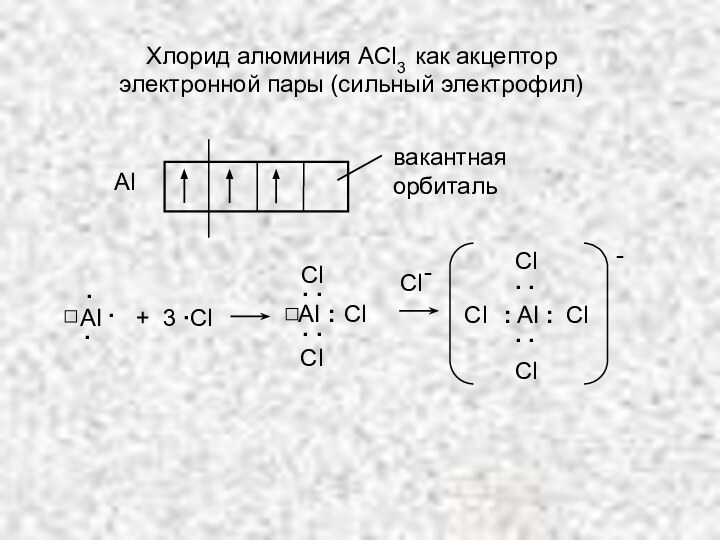
ЭЛЕКТРОФИЛЬНЫЕ РЕАГЕНТЫ:
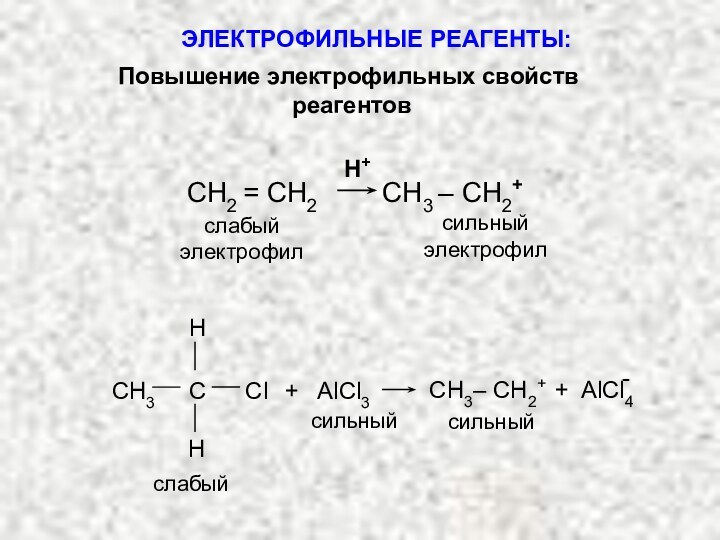
Слабые: молекулы, обладающие небольшим сродством к электрону, которое может быть повышено образованием комплексов с сильными электрофилами:
сильный
электрофил
слабый
сильный
сильный
ЭЛЕКТРОФИЛЬНЫЕ РЕАГЕНТЫ:
НУКЛЕОФИЛЫ
Нуклеофилы – это атомы или молекулы, обладающие центрами с избыточной электронной плотностью.
Примеры нейтральных молекул с сильными нуклеофильными свойствами:
СЛАБЫЕ НУКЛЕОФИЛЫ:
НУКЛЕОФИЛЫ
НУКЛЕОФИЛЫ И ОСНОВАНИЯ
Классификация реакций и реагентов в органической химии
НУКЛЕОФИЛЬНОСТЬ И ОСНОВНОСТЬ
Классификация реакций и реагентов в органической химии
НУКЛЕОФИЛЬНОСТЬ И ОСНОВНОСТЬ
Карбанионы – органические ионы с отрицательно заряженным атомом углерода.
Свободный радикал – атом или группа, имеющие нечетный (неспаренный) электрон. Радикальные частицы – электрически нейтральные частицы
Протекание многих органических реакций сопро-вождается образованием промежуточных продуктов: радикалов и ионов.
2. – С : Z – С:− + Z+
\ \
/ /
(X = Li, Na, K и др.)
Br : Br Br• + • Br
h٧
3.
H▪ + ▪Br = H–Br
1. Замещение (S) 1.Электрофильные (Е+)
2. Присоединение (A) 2. Нуклеофильные (Nu-)
По электронной природе реагента:
3.Отщепление
3. Радикальные (R)
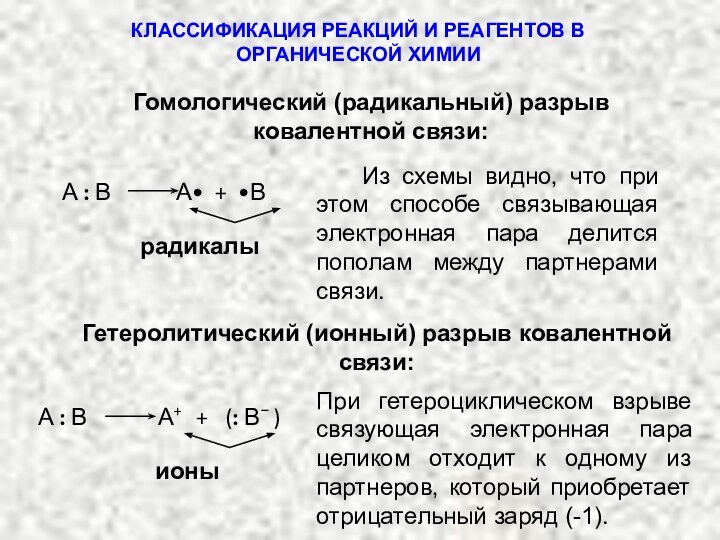
КЛАССИФИКАЦИЯ РЕАКЦИЙ И РЕАГЕНТОВ В ОРГАНИЧЕСКОЙ ХИМИИ
Гетеролитический (ионный) разрыв ковалентной связи:
А : В А+ + (: В− )
ионы
При гетероциклическом взрыве связующая электронная пара целиком отходит к одному из партнеров, который приобретает отрицательный заряд (-1).
КЛАССИФИКАЦИЯ РЕАКЦИЙ И РЕАГЕНТОВ В ОРГАНИЧЕСКОЙ ХИМИИ
КЛАССИФИКАЦИЯ РЕАКЦИЙ И РЕАГЕНТОВ В ОРГАНИЧЕСКОЙ ХИМИИ
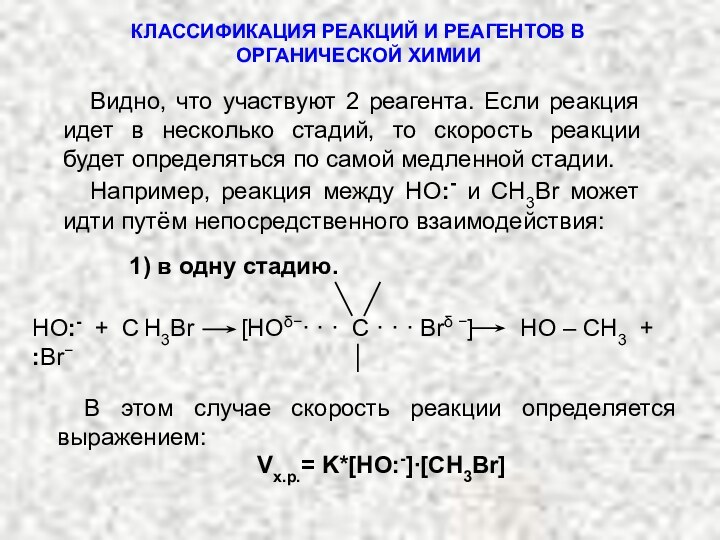
1) в одну стадию.
HO:- + C H3Br [HOδ−· · · C · · · Brδ −] HO – CH3 + :Br−
В этом случае скорость реакции определяется выражением:
Vх.р.= K*[НО:-]∙[СН3Br]
КЛАССИФИКАЦИЯ РЕАКЦИЙ И РЕАГЕНТОВ В ОРГАНИЧЕСКОЙ ХИМИИ
КЛАССИФИКАЦИЯ РЕАКЦИЙ И РЕАГЕНТОВ В ОРГАНИЧЕСКОЙ ХИМИИ