- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Азот
Содержание
- 2. Строение атома«Паспорт Элемента»Химический элемент таблицы Менделеева, неметалл.
- 3. ФИЗИЧЕСКИЕ СВОЙСТВАПри нормальных условиях азот это бесцветный
- 4. ХИМИЧЕСКИЕ СВОЙСТВАВвиду своей значительной инертности азот при
- 5. Получение В лабораториях его можно получать
- 6. ПолучениеЕщё один лабораторный способ получения азота — нагревание
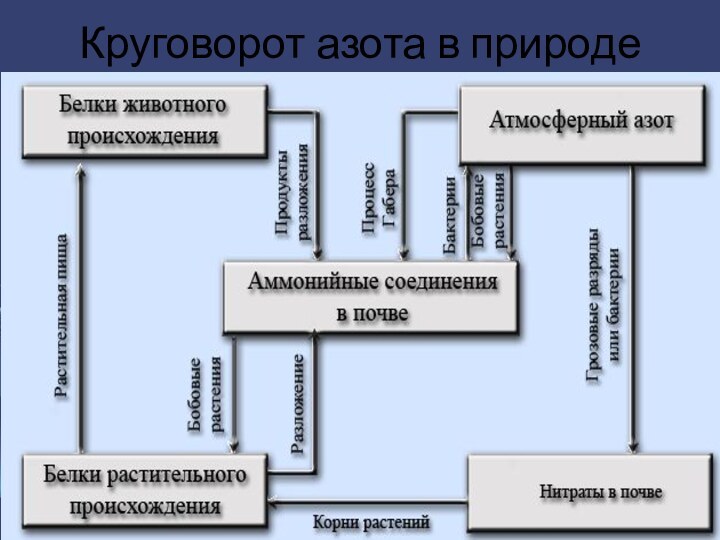
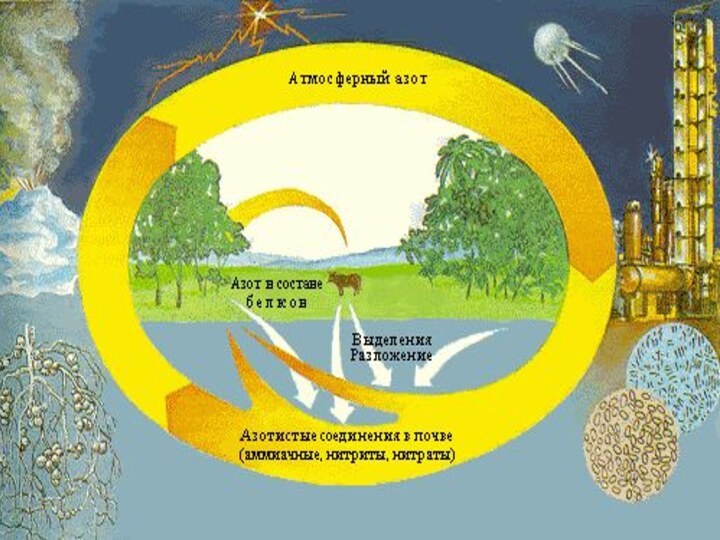
- 7. Круговорот азота в природе
- 9. Применение азотаЖидкий азот применяется как хладагент и для криотерапии.Промышленные применения
- 10. Важной областью применения азота является его использование
- 11. Нахождение в природеВне пределов Земли азот обнаружен
- 12. Скачать презентацию
- 13. Похожие презентации
Строение атома«Паспорт Элемента»Химический элемент таблицы Менделеева, неметалл. Символ элемента: N. Атомный номер: 7. Положение в таблице: 2-й период, группа - VA (15) Относительная атомная масса: 14.00674 Степени окисления (жирным шрифтом выделена наиболее характерная): -3,+1,+2,+3,+4,+5 Валентности (жирным шрифтом выделены наиболее характерные): I,II,III,IV,V Электроотрицательность: 3.07









Слайд 2
Строение атома
«Паспорт Элемента»
Химический элемент таблицы Менделеева, неметалл.
Символ элемента: N.
Атомный
Слайд 3
ФИЗИЧЕСКИЕ СВОЙСТВА
При нормальных условиях азот это бесцветный газ,
не имеет запаха, мало растворим в воде (2,3 мл/100г
при 0 °C, 0,8 мл/100 г при 80 °C), плотность 1,2506 кг/м³ (при н.у.).В жидком состоянии (темп. кипения −195,8 °C) — бесцветная, подвижная, как вода, жидкость. Плотность жидкого азота 808 кг/м³. При контакте с воздухом поглощает из него кислород.
При −209,86 °C азот переходит в твердое состояние в виде снегоподобной массы или больших белоснежных кристаллов. При контакте с воздухом поглощает из него кислород, при этом плавится, образуя раствор кислорода в азоте.
Слайд 4
ХИМИЧЕСКИЕ СВОЙСТВА
Ввиду своей значительной инертности азот при обычных
условиях реагирует только с литием:
6Li + N2 → 2Li3N,
при нагревании он
реагирует с некоторыми другими металлами и неметаллами, также образуя нитриды:3Mg + N2 → Mg3N2,
2В + N2 →2BN
Слайд 5
Получение
В лабораториях его можно получать по реакции разложения нитрита
аммония:
NH4NO2 → N2↑ + 2H2O
Реакция экзотермическая, идёт с выделением 80
ккал (335 кДж), поэтому требуется охлаждение сосуда при её протекании (хотя для начала реакции требуется нагревание нитрита аммония).
Слайд 6
Получение
Ещё один лабораторный способ получения азота — нагревание смеси дихромата
калия и сульфата аммония (в соотношении 2:1 по массе). Реакция
идёт по уравнениям:K2Cr2O7 + (NH4)2SO4 = (NH4)2Cr2O7 + K2SO4
(NH4)2Cr2O7 →(t) Cr2O3 + N2↑ + 4H2O
Самый чистый азот можно получить разложением азидов металлов:
2NaN3 →(t) 2Na + 3N2↑
Слайд 9
Применение азота
Жидкий азот применяется как хладагент и для криотерапии.
Промышленные применения газообразного
азота обусловлены его инертными свойствами. Газообразный азот пожаро- и
взрывобезопасен, препятствует окислению, гниению. В нефтехимии азот применяется для продувки резервуаров и трубопроводов, проверки работы трубопроводов под давлением, увеличения выработки месторождений. В горнодобывающем деле азот может использоваться для создания в шахтах взрывобезопасной среды. В производстве электроники азот применяется для продувки областей, не допускающих наличия окисляющего кислорода.Слайд 10 Важной областью применения азота является его использование для
дальнейшего синтеза самых разнообразных соединений, содержащих азот, таких, как аммиак, азотные
удобрения, взрывчатые вещества, красители и т. п. Большие количества азота используются в коксовом производстве («сухое тушение кокса») при выгрузке кокса из коксовых батарей, а также для «передавливания» топлива в ракетах из баков в насосы или двигатели.В пищевой промышленности азот зарегистрирован в качестве пищевой добавки E941, как газовая среда для упаковки и хранения, хладагент, а жидкий азот применяется при разливе масел и негазированных напитков для создания избыточного давления и инертной среды в мягкой таре.
Слайд 11
Нахождение в природе
Вне пределов Земли азот обнаружен в
газовых туманностях, солнечной атмосфере, на Уране, Нептуне, межзвёздном пространстве и др. Азот — четвёртый
по распространённости элемент Солнечной системы (после водорода, гелия и кислорода).Азот, в форме двухатомных молекул N2 составляет большую часть атмосферы, где его содержание составляет 75,6 % (по массе) или 78,084 % (по объёму), то есть около 3,87×1015 т.
Содержание азота в земной коре, по данным разных авторов, составляет (0,7—1,5)×1015 т (причём в гумусе — порядка 6×1010т), а в мантии Земли — 1,3×1016 т. Такое соотношение масс заставляет предположить, что главным источником азота служит верхняя часть мантии, откуда он поступает в другие оболочки Земли с извержениями вулканов.





























