- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Классы неорганических соединений
Содержание
- 2. Химические элементы, в зависимости от строения и свойств их атомов:металлынеметаллы
- 3. ПЕРИОДИЧЕСКАЯ СИСТЕМА ХИМИЧЕСКИХ ЭЛЕМЕНТОВМЕТАЛЛЫНЕМЕТАЛЛЫ
- 4. Положение неметаллических элементов в периодической системе химических элементов
- 5. НеметаллыБольшое число е на внешнем уровне (4-8),
- 9. Щелочные металлы – главная подгруппа
- 10. Переходные элементы, проявляющие в соединениях амфотерные свойства9
- 11. Сложные вещества по химическим свойствам:ОксидыГидроксиды (Основания, Кислоты)Соли
- 12. Оксиды– сложные вещества, состоящие из двух элементов, одним из которых является О.
- 13. Оксидысолеобразующие (образуют соли – СuO, SO3) несолеобразующие (не дают солей – СО, NО)
- 14. Оксиды (по химическим свойствам)основные (гидраты которых являются основаниями – CaO, Na2O)
- 15. Оксиды (по химическим свойствам)кислотные (гидраты которых являются кислотами - SO3, CO2)
- 16. Оксиды (по химическим свойствам)амфотерные (проявляют либо основные, либо кислотные свойства – ZnO, Al2O3)
- 17. Основания– сложные вещества, молекула которых состоит из
- 18. Основания Гидроксиды щелочных и щелочно-земельных Ме – щелочи (КОН, NаОН, Ва(ОН)2)
- 19. Основания по количеству гидроксильных групп: однокислотные (NаОН),двукислотные (Ва(ОН)2),многокислотные (Fe(ОН)3).
- 20. Химические свойства щелочей растворы имеют рН>7изменяют окраску
- 21. Химические свойства нерастворимых оснований не изменяют окраску индикаторов.при нагревании разлагаются Cu(OH)2 → CuO + H2O
- 22. Кислоты сложные вещества, молекулы которых состоят из
- 23. Кислоты по количеству атомов водорода: одноосновные (HCl, HNO3),двухосновные (H2SO4 , H2S)многоосновные (H3PO4).
- 24. Кислоты по элементному составу:кислородсодержащие (HNO3 , H3PO4)бескислородные (HCl, H2S)
- 25. Номенклатура кислот и солей
- 26. Номенклатура кислот и солей
- 27. Номенклатура кислот и солей
- 28. Химические свойства кислотрастворы имеют рН
- 29. Амфотерные гидроксиды две формы Zn(OН)2 – основная и кислотная: Zn(OН)2 и H2ZnO2
- 30. Амфотерные гидроксиды и с основаниями, и с
- 31. Соли – продукты полного или частичного замещения
- 32. Соли или продукт полного или частичного замещения
- 33. Соли от состава:средние – продукты полного замещения атомов Н в молекуле кислоты (MgSO4 , Ca3(PO4)2)
- 34. Соли от состава:кислые - частичного замещения Н (КН2PO4 , К2НPO4) – гидро-
- 35. Соли от состава:основные – частичного замещения ОН (Al(OH)2Cl , MgOHI) – гидроксо-
- 36. Скачать презентацию
- 37. Похожие презентации
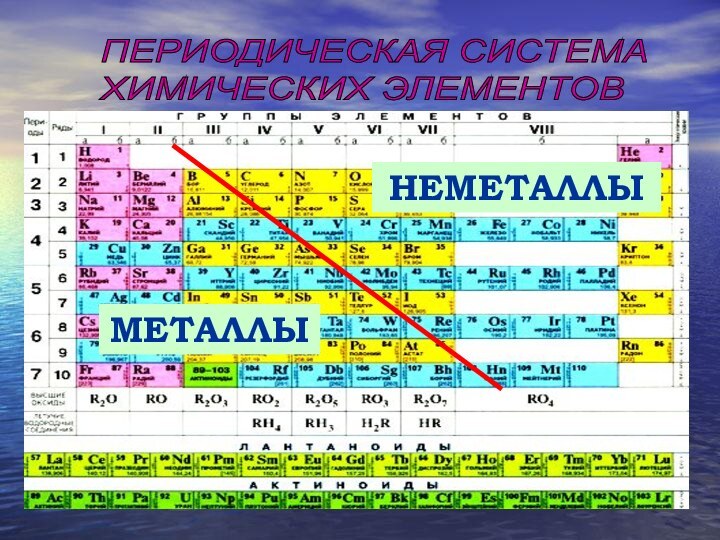
Химические элементы, в зависимости от строения и свойств их атомов:металлынеметаллы


































Слайд 5
Неметаллы
Большое число е на внешнем уровне (4-8), иск.
водород и бор
Принимают недостающие е – окислительные свойства
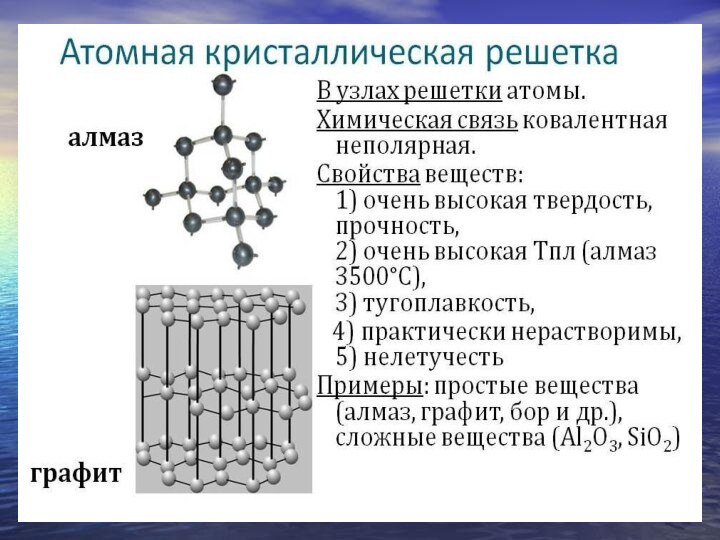
Кристаллическая решетка:
молекулярная (газы), атомная (алмаз, графит, кремний…)Труднее выделить общие характерные признаки: газы (хлор), жидкости (бром), твердые вещества (иод)
Металлы
Небольшое число е на внешнем уровне (1-3)
Отдают е – восстановительные свойства
Кристаллическая решетка – металлическая
Твердые вещества, кроме ртути
Неметаллы
Большое число е на внешнем уровне (4-8), иск. водород и бор
Принимают недостающие е – окислительные свойства
Кристаллическая решетка: молекулярная (газы), атомная (алмаз, графит, кремний…)
Труднее выделить общие характерные признаки: газы (хлор), жидкости (бром), твердые вещества (иод)
Слайд 9 Щелочные металлы – главная подгруппа I группы –
отдают 1 е – образуют щелочи Щелочноземельные металлы – главная
подгруппа II группы – отдают 2 е – оксиды называли «земли» - образуют щелочи Галогены – «рождающие соли» - главная подгруппа VII группы – принимают 1 е
Слайд 10
Переходные элементы, проявляющие в соединениях амфотерные свойства
9 элементов
главных подгрупп:
бериллий(4), алюминий(13), галлий(31), германий(32), олово(50), свинец(82), сурьма(51), висмут(83),
полоний(84)Все элементы побочных подгрупп, кроме скандия(21), иттрия(39)
Слайд 14
Оксиды (по химическим свойствам)
основные
(гидраты которых являются основаниями
– CaO, Na2O)
Слайд 16
Оксиды (по химическим свойствам)
амфотерные
(проявляют либо основные, либо
кислотные свойства – ZnO, Al2O3)
Слайд 17
Основания
– сложные вещества, молекула которых состоит из атома
Ме и одной или нескольких гидроксильных групп. Общая формула
– Ме(ОН)n
Слайд 19
Основания по количеству гидроксильных групп:
однокислотные (NаОН),
двукислотные (Ва(ОН)2),
многокислотные
(Fe(ОН)3).
Слайд 20
Химические свойства щелочей
растворы имеют рН>7
изменяют окраску индикаторов:
- лакмус – синяя,
- фенолфталеин – малиновая,
- метиловый оранжевый
– желтая.устойчивы к нагреванию





























