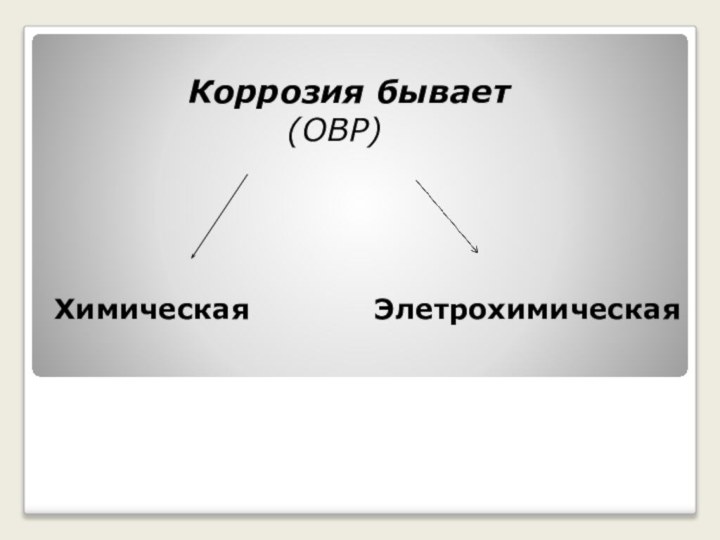
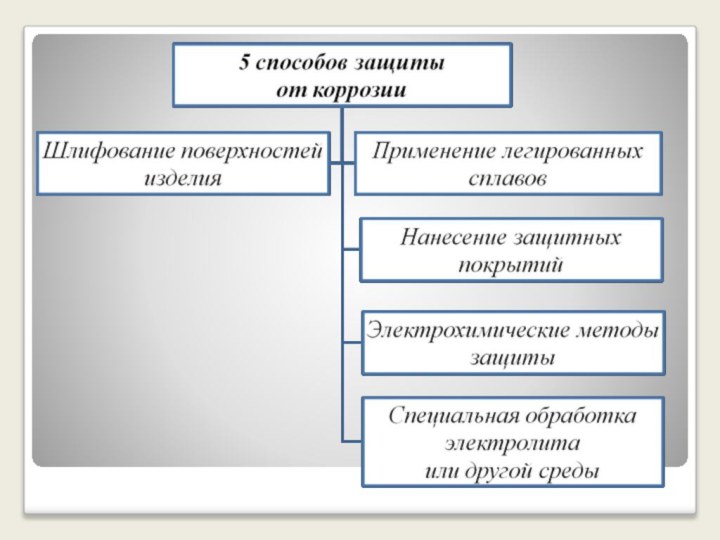
металлов и сплавов под влиянием внешней среды. Все металлы- восстановители
, вещества вызывающие коррозию металлов-то окислители( не Ме О2, Cl2, неорганичные и органичные кислоты ,щёлочи)Слово коррозия происходит от латинского «corrodo» – «грызу»
(позднелатинское «corrosio» означает «разъедание»).