- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Карбоновые кислоты
Содержание
- 2. Карбоновые кислотыКарбоновые кислоты – это органические вещества, содержащие в своем составе карбоксильную группу (- COOH).
- 3. Классификация карбоновых кислотI. По числу карбоксильных групп
- 4. Классификация карбоновых кислотH3C – COOH уксусная (этановая)
- 5. Классификация карбоновых кислотH3C – CH2 – CH2
- 6. Классификация карбоновых кислотH3C – CH2 – CH2
- 7. Классификация карбоновых кислотb) поликарбоновые – содержат в
- 8. малеиновая кислота(цис-бутендиовая кислота)Токсична, в природе не встречается.
- 9. Классификация карбоновых кислотII. В зависимости от наличия
- 10. Классификация карбоновых кислот COOHHO –
- 11. Классификация карбоновых кислот
- 12. Классификация карбоновых кислот Гидроксикислоты являются,
- 13. Классификация карбоновых кислотb) оксо- (кетоно-) кислоты –
- 14. Классификация карбоновых кислот
- 15. Классификация карбоновых кислот III. Особую группу
- 16. b) непредельные.Пример: C17H33COOH – олеиновая кислота (одна
- 17. α-метилмасляная кислота2-метилбутановая кислотаНоменклатура карбоновых кислот
- 18. Физические свойства Карбоновые кислоты в растворе находятся в виде димеров.
- 19. Физические свойства Низшие жирные кислоты
- 20. Физические свойстваРис. 2. Температуры кипения в гомологическом ряду карбоновых кислот, альдегидов и спиртов.
- 21. Физические свойства Первые члены гомологического
- 22. Строение карбоксильной группы
- 23. В карбоновых кислотах частичный
- 24. Строение карбоксильной группы В карбоновых
- 25. Кислотные свойстваВзаимодействие снуклеофильными реагентами по карбонильному углеродуВосстановление до CH2Декарбоксилированиеα-H реакцииХимические свойства
- 26. I. Реакции диссоциации (в «OH»-кислотном центре):
- 27. K = 2.14·10-4 K = 1.75·10-5Химические свойства
- 28. Химические свойстваII. Образование солей: а) С активными металлами: 2
- 29. Образование солей дикарбоновыми кислотами: гидрооксалат
- 30. Около 80% почечных камней образуется из оксалата кальция.Химические свойства
- 31. Химические свойствамолочная кислота
- 32. Химические свойстваIII. Реакции галогенирования (в СН -
- 33. Химические свойстваIV. Реакции декарбоксилированияIn vitro реакции протекают
- 34. Химические свойства COOH
- 35. Химические свойстваc) Реакции окислительного декарбоксилированияПример: Превращение ПВК
- 36. Структура Коэнзима А: Химические свойства
- 37. Химические свойстваV. Реакции этерификации или нуклеофильного замещения
- 38. Химические свойстваVI. Межмолекулярная дегидратация с образованием ангидридов
- 39. Химические свойства VII. Окисление карбоновых
- 40. Химические свойства Процесс α-окисления идёт
- 41. Химические свойстваОкисление дикарбоновых кислот in vivo:янтарная кислота фумаровая кислота
- 42. Химические свойстваVII. Реакции окисления гидроксикислотa) Окисление молочной
- 43. Химические свойстваb) Окисление яблочной кислоты
- 44. Химические свойствас) Окисление β-гидроксимасляной кислоты
- 45. Химические свойстваH3C C CH2
- 46. Химические свойстваСпецифические свойства винной кислоты – образование
- 47. Салициловая кислота, фарм. препараты на её основеСалициловая
- 48. Салициловая кислота, фарм. препараты на её основе
- 49. Метилсалицилат:Используется как противовоспалительное, анальгетическое средство наружно (в виде мазей). Салициловая кислота, фарм. препараты на её основе
- 50. Салицилат натрия:Применяется в качестве анальгетического, противовоспалительного, жаропонижающего средства. Салициловая кислота, фарм. препараты на её основе
- 51. Фенилсалицилат: салицилат
- 52. Ацетилсалициловая кислота (аспирин):Ацетилсалициловая кислота используется в качестве
- 53. Салициловая кислота и её производные со свободной
- 54. Скачать презентацию
- 55. Похожие презентации










































Слайд 2
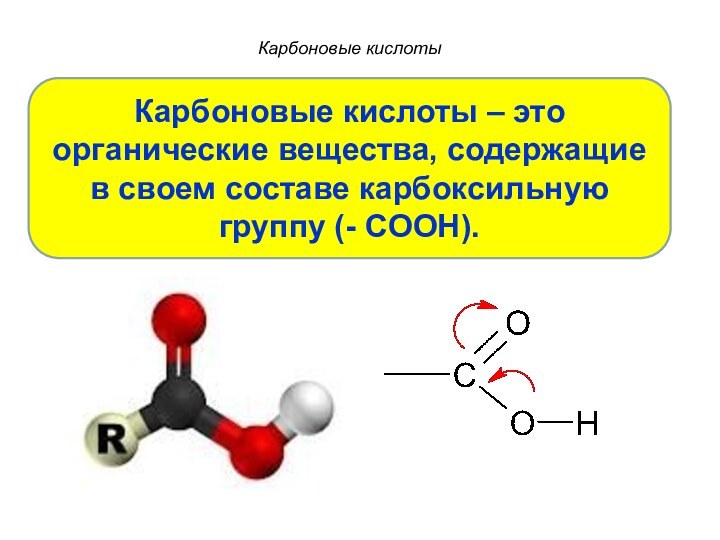
Карбоновые кислоты
Карбоновые кислоты – это органические вещества, содержащие
в своем составе карбоксильную группу (- COOH).
Слайд 3
Классификация карбоновых кислот
I. По числу карбоксильных групп различают:
монокарбоновые
– содержат одну карбоксильную группу.
Пример: гомологический ряд предельных одноосновных
кислотCnH2n + 1COOH, n = 0, 1, 2, 3, 4 …
HCOOH муравьиная (метановая) кислота (соли – формиаты)
Слайд 4
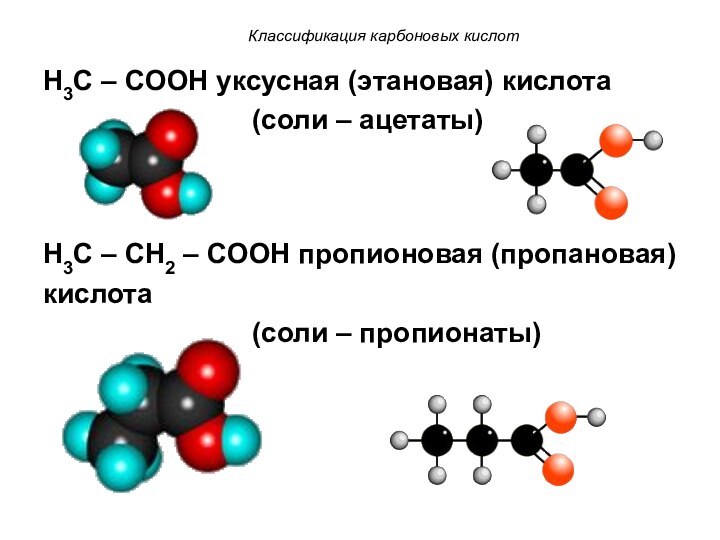
Классификация карбоновых кислот
H3C – COOH уксусная (этановая) кислота
(соли – ацетаты)
H3C – CH2 – COOH пропионовая (пропановая)
кислота
(соли – пропионаты)
Слайд 5
Классификация карбоновых кислот
H3C – CH2 – CH2 –
COOH масляная
(бутановая) кислота (соли – бутираты)
H3C – CH2
– CH2 – CH2 – COOH валериановая (пентановая кислота) кислота (соли –
валераты)
Слайд 6
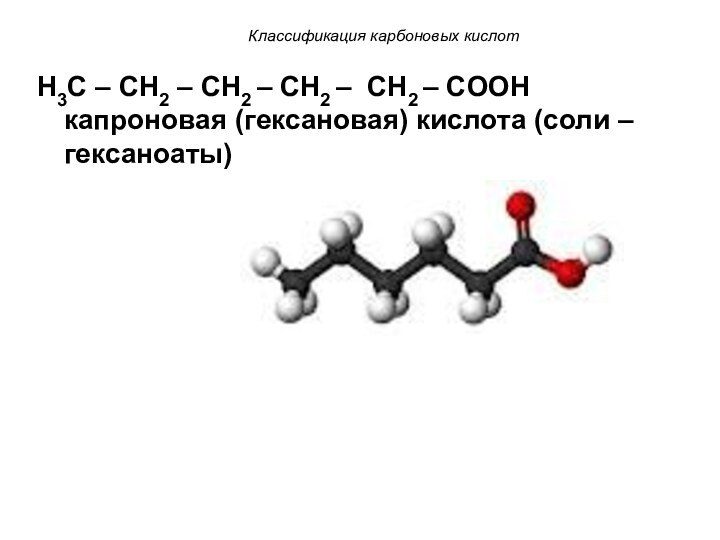
Классификация карбоновых кислот
H3C – CH2 – CH2 –
CH2 – CH2 – COOH капроновая (гексановая) кислота (соли
– гексаноаты)
Слайд 7
Классификация карбоновых кислот
b) поликарбоновые – содержат в своем
составе две и более карбоксильные группы.
Пример: гомологический ряд предельных
дикарбоновых кислотHOOC – CnH2n – COOH, n = 0, 1, 2, 3, 4 …
HOOC – COOH щавелевая (этандиовая) кислота (соли – оксалаты),
HOOC – CH2 – COOH малоновая (пропандиовая) кислота (соли – малонаты),
HOOC – CH2 – CH2 – COOH янтарная (бутандиовая) кислота (соли – сукцинаты),
HOOC – CH2 – CH2 – CH2 – COOH глутаровая (пентандиовая) кислота (соли – глутараты).
Слайд 8
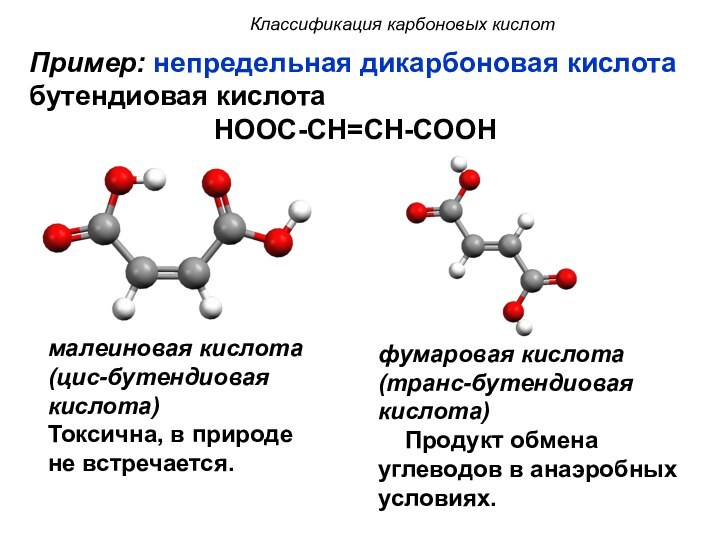
малеиновая кислота
(цис-бутендиовая кислота)
Токсична, в природе не встречается.
фумаровая
кислота
(транс-бутендиовая кислота)
Продукт обмена углеводов в анаэробных условиях.
Пример: непредельная дикарбоновая кислота
бутендиовая кислота
НООС-СН=СН-СООН
Классификация карбоновых кислот
Слайд 9
Классификация карбоновых кислот
II. В зависимости от наличия младших
функциональных групп различают: a) гидроксикислоты
COOH HO – C – H
CH3
L (+) - молочная (2 – гидроксипропановая) кислота (соли – лактаты)
Пример:
L – молочная кислота D – молочная кислота
Слайд 10
Классификация карбоновых кислот
COOH
HO – C
– H
CH2
COOH
L (-) –яблочная кислота
(2- гидроксибутандиовая) кислота (соли – малаты)
Слайд 11
Классификация карбоновых кислот
COOH
CH2
H – C
– OHCH3
D(+) – β-гидроксимасляная
(2-гидроксибутановая) кислота,
соли – β-гидроксибутираты
COOH
HO – C – CH2 – COOH
СH2 – COOH
лимонная (2-гидроксипропан-
1,2,3-трикарбоновая) кислота, соли – цитраты
Слайд 12
Классификация карбоновых кислот
Гидроксикислоты являются, как
правило, твёрдыми телами. Рацемическая молочная кислота может быть жидкой
(т. пл. 18оС).Запахом гидроксикислоты почти не обладают.
Гидроксикислоты имеют очень большое значение в биологической химии; их можно встретить во многих очень важных метаболических путях – цикле Кребса, гликолизе, пентозофосфатном цикле, b-окислении жирных кислот, биосинтезе жирных кислот и т.д.
Слайд 13
Классификация карбоновых кислот
b) оксо- (кетоно-) кислоты – содержат
в своем составе карбонильную группу. Пример:
COOH
C = O
CH3
пировиноградная (2-оксопропановая) кислота (ПВК), соли – пируваты
COOH
C=O
CH2
COOH
щавелевоуксусная (2-оксобутандиовая) кислота
(ЩУК), соли – соли щавелевоуксусной кислоты
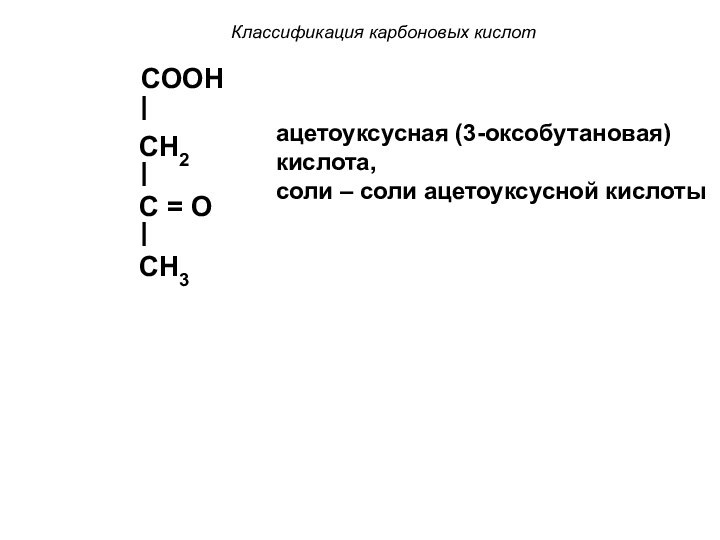
Слайд 14
Классификация карбоновых кислот
COOH
CH2
C = O
CH3
ацетоуксусная (3-оксобутановая) кислота,
cоли – соли ацетоуксусной
кислоты
Слайд 15
Классификация карбоновых кислот
III. Особую группу составляют
высшие (жирные) карбоновые кислоты (ВЖК); входят в состав липидов.
Различают
ВЖК:предельные.
Пример: C15H31COOH – пальмитиновая кислота,
C17H35COOH – стеариновая кислота,
C23H47COOH – лигноцириновая кислота,
C23H46 (OH)COOH – цереброновая кислота;
Слайд 16
b) непредельные.
Пример: C17H33COOH – олеиновая кислота (одна двойная
связь),
C17H31COOH – линолевая кислота (две двойных связи),
C17H29COOH –
линоленовая кислота (три двойных связи),C23H45COOH – нервоновая кислота (одна двойная связь).
Классификация карбоновых кислот
Слайд 19
Физические свойства
Низшие жирные кислоты представляют
собой легкоподвижные жидкости, средние члены – масла, высшие –
твёрдые кристаллические вещества.Рис. 1. Температуры плавления карбоновых кислот.
Слайд 20
Физические свойства
Рис. 2. Температуры кипения в гомологическом ряду
карбоновых кислот, альдегидов и спиртов.
Слайд 21
Физические свойства
Первые члены гомологического ряда
карбоновых кислот обладают резким запахом, средние – прогорклым, неприятным,
например, масляная кислота пахнет потом, высшие карбоновые кислоты вследствие нелетучести лишены запаха.Карбоновые кислоты, как правило, не ядовиты, однако приём внутрь концентрированных растворов (например, уксусной эссенции) вызывает тяжёлые ожоги. Нежелательно попадание этих растворов на кожу и тем более внутрь.
Слайд 22
Строение карбоксильной группы
Оδ-
Сδ+
Оδ- Нδ+..
Карбоксильная группа представляет собой плоскую p-π –сопряженную систему за счет взаимодействия pz–АО кислорода гидрокси-группы с π-связью карбонильной группы. Это приводит к повышению кислотных свойств карбоновых кислот по сравнению со спиртами.
Слайд 23 В карбоновых кислотах частичный положительный
заряд на атоме углерода меньше, чем в альдегидах и
кетонах, поэтому для карбоновых кислот менее характерны реакции нуклеофильного присоединения (AN) по сравнению с альдегидами и кетонами.Строение карбоксильной группы
Слайд 24
Строение карбоксильной группы
В карбоновых кислотах
выделяют следующие
реакционные центры:
Oδ- 1R CH Cδ+
H OH
4 2 3
1 – основный, нуклеофильный центр,
2 – электрофильный центр,
3 – «OH» - кислотный центр,
4 – «CH» - кислотный центр.
α
Слайд 25
Кислотные свойства
Взаимодействие с
нуклеофильными реагентами
по карбонильному углероду
Восстановление до
CH2
Декарбоксилирование
α-H реакции
Химические свойства
Слайд 26
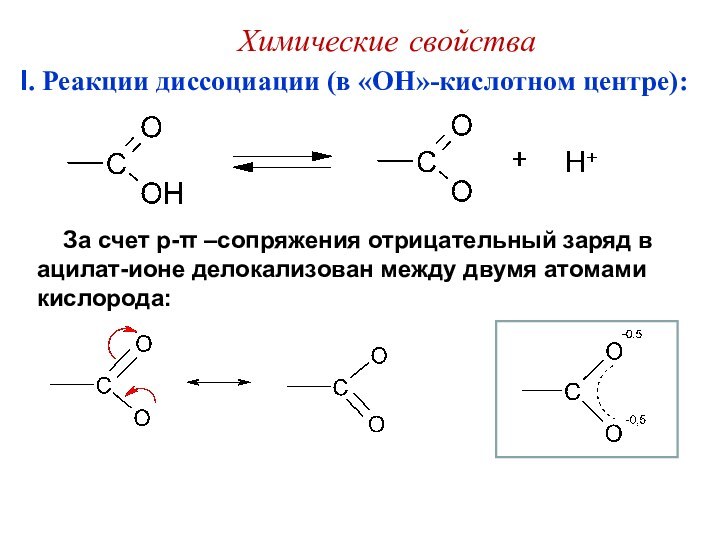
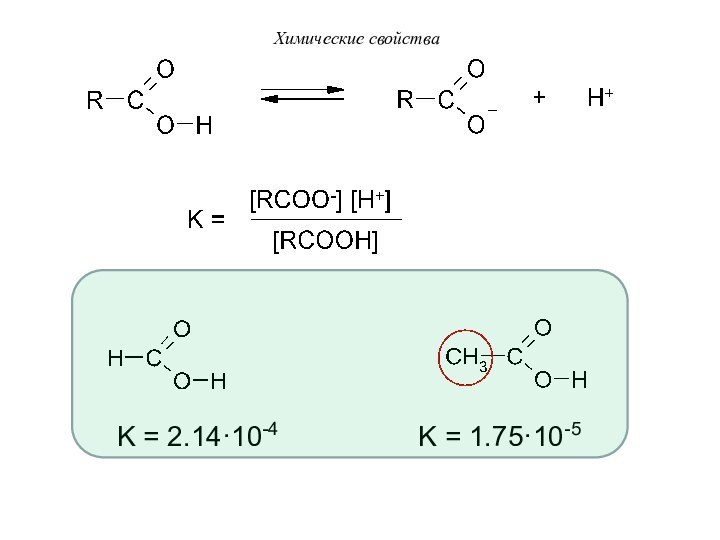
I. Реакции диссоциации (в «OH»-кислотном центре):
За
счет p-π –сопряжения отрицательный заряд в ацилат-ионе делокализован между
двумя атомами кислорода:Химические свойства
Слайд 28
Химические свойства
II. Образование солей:
а) С активными металлами:
2 CH3COOH
+ Mg → (CH3COO)2Mg + H2
б) С основными оксидами:
2
CH3COOH + CaO → (CH3COO)2Ca + H2Oв) Со щелочами (реакция нейтрализации):
CH3COOH + NaOH → CH3COONa + H2O
г) С солями более слабых кислот:
CH3COOH + NaHCO3 → CH3COONa + CO2 ↑+ H2O
2 CH3COOH + Na2CO3 → 2 CH3COONa + CO2 ↑+ H2O
Эти реакции используются как качественные на карбоксильную группу (по выделению пузырьков CO2).
Слайд 29
Образование солей дикарбоновыми кислотами:
гидрооксалат натрия
оксалат натрия
(кислая соль) (средняя соль)оксалат кальция
Химические свойства
Слайд 31
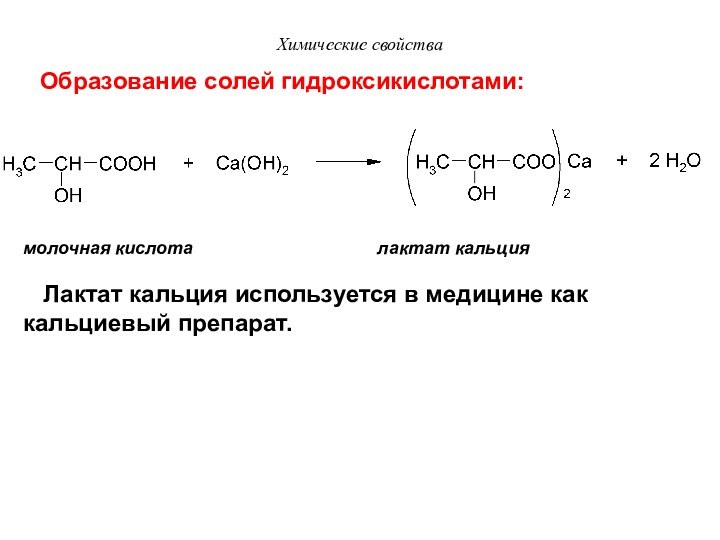
Химические свойства
молочная кислота
лактат кальция
Образование солей гидроксикислотами:
Лактат кальция используется в медицине как кальциевый препарат.
Слайд 32
Химические свойства
III. Реакции галогенирования (в СН - кислотном
центре):
CH3 CH2 COOH + Br2
CH3 CH COOH + HBrBr
пропионовая кислота α- бромпропионовая кислота
Слайд 33
Химические свойства
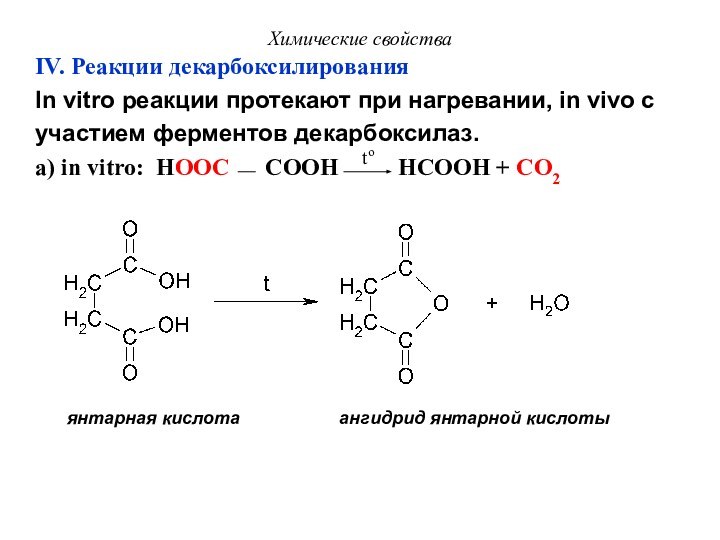
IV. Реакции декарбоксилирования
In vitro реакции протекают при
нагревании, in vivo с
участием ферментов декарбоксилаз.
а) in vitro:
HOOC COOH HCOOH + CO2 to
янтарная кислота ангидрид янтарной кислоты
Слайд 34
Химические свойства
COOH
COOH
CH2 CH2
CH2 CH2
CH2 CH3
COOH
глутаровая кислота масляная кислота
F
-CO2
б) in vivo:
Слайд 35
Химические свойства
c) Реакции окислительного декарбоксилирования
Пример: Превращение ПВК в
митохондриях с участием
декарбоксилазы (F), дегидрогеназы (НАД+) и кофермента
А (HS – KoA).
O
H3C C COOH H3C C
O H
O
H3C C + НАД·H - -H+ S KoA
F
-CO2
HS – KoA, НАД+
Ацетил -KoA
Ацетилкофермент A вовлекается в цикл трикарбоновых кислот или цикл Кребса.
Слайд 37
Химические свойства
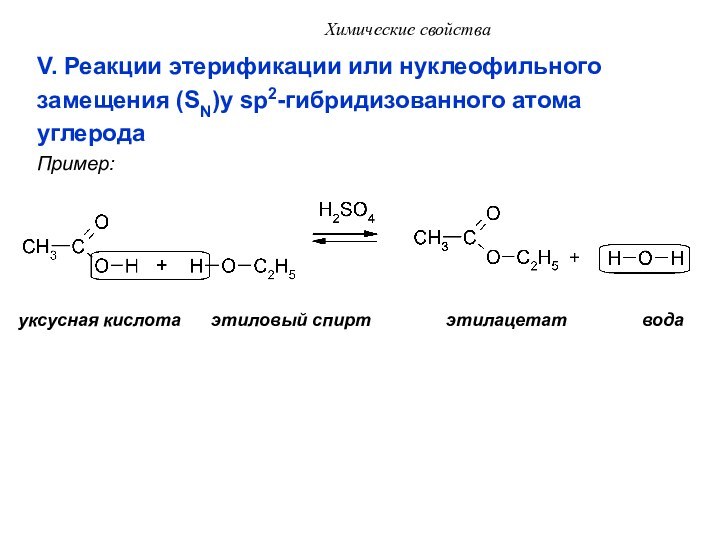
V. Реакции этерификации или нуклеофильного
замещения (SN)у
sp2-гибридизованного атома
углерода
Пример:
уксусная кислота этиловый спирт этилацетат вода
Слайд 38
Химические свойства
VI. Межмолекулярная дегидратация с образованием ангидридов (при
пропускании паров кислот над водоотнимающими средствами
P2O5, H2SO4конц:“Ангидрид” (an – отрицающая частица, греч. udor – вода) означает “лишённый воды”.
Слайд 39
Химические свойства
VII. Окисление карбоновых кислот
В организме карбоновые кислоты окисляются в основном
за счёт т.н. b-окисления. Кроме того in vivo встречается также α- и w-окисление.In vitro некоторые аналогичные реакции b-окисления можно осуществить с помощью 3% перекиси водорода.
Слайд 40
Химические свойства
Процесс α-окисления идёт в
пероксисомах. При нарушении этого процесса развивается синдром Рефсума, характеризующийся
накоплением фитановой кислоты в мозге.α-Окисление:
Слайд 41
Химические свойства
Окисление дикарбоновых кислот in vivo:
янтарная кислота
фумаровая кислота
Слайд 42
Химические свойства
VII. Реакции окисления гидроксикислот
a) Окисление молочной кислоты
COOH
COOHHO C H C O
CH3 CH3
молочная кислота
+ НАД+
- НАД · H, - H+
пировиноградная кислота
Слайд 43
Химические свойства
b) Окисление яблочной кислоты
COOH
COOHHO C H C O
CH2 CH2
COOH COOH
яблочная кислота
+ НАД+
- НАД ·H, - H+
щавелевоуксусная
кислота
Слайд 44
Химические свойства
с) Окисление β-гидроксимасляной кислоты
COOH
COOHCH2 CH2
H C OH C O
CH3 CH3
+ НАД+
- НАД ·H, - H+
β –гидрокимасляная
кислота
ацетоуксусная кислота
Слайд 45
Химические свойства
H3C C CH2 COOH
+ H2O
2 H3C COOHO
В норме ацетоуксусная кислота подвергается гидролитическому расщеплению с образованием двух молекул уксусной кислоты.
уксусная кислота
Уксусная кислота, вовлекаясь в обменные процессы, окисляется до конечных продуктов CO2 и H2O. При патологии (сахарном диабете) идет декарбоксилирование уксусной кислоты.
H3C C CH2 COOH H3C C CH3 + CO2
O O
ацетон
В крови больных накапливаются кетоновые тела: β-гидрокимасляная кислота, ацетоуксусная кислота, ацетон.
F
Слайд 46
Химические свойства
Специфические свойства винной кислоты – образование хелатных
комплексов с ионами металлов.
L-винная кислота D-винная кислота
мезовинная кислота
Слайд 47
Салициловая кислота, фарм. препараты на её основе
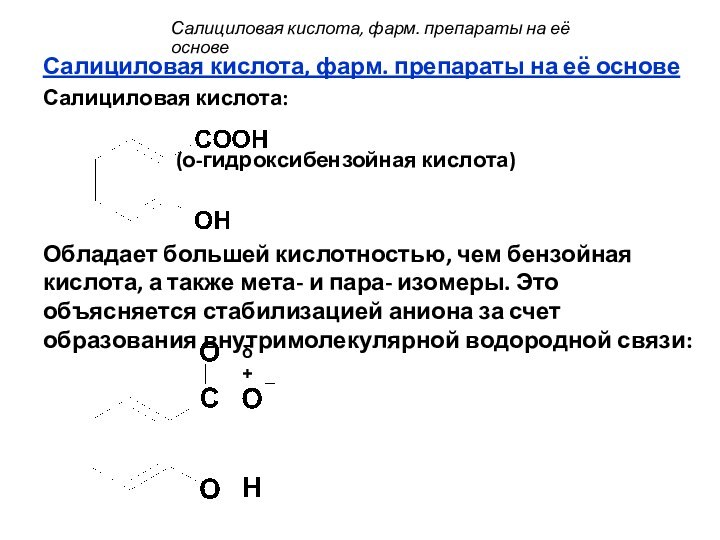
Салициловая кислота:
(о-гидроксибензойная кислота)
Обладает большей кислотностью, чем
бензойная кислота, а также мета- и пара- изомеры. Это объясняется стабилизацией аниона за счет образования внутримолекулярной водородной связи:
δ+
Салициловая кислота, фарм. препараты на её основе
Слайд 48
Салициловая кислота, фарм. препараты на её основе
Салициловая кислота применяется в медицине в виде спиртовых
растворов и мазей как антисептическое лекарственное средство.
Слайд 49
Метилсалицилат:
Используется как противовоспалительное, анальгетическое средство наружно (в виде
мазей).
Салициловая кислота, фарм. препараты на её основе
Слайд 50
Салицилат натрия:
Применяется в качестве анальгетического, противовоспалительного, жаропонижающего средства.
Салициловая кислота, фарм. препараты на её основе
Слайд 51
Фенилсалицилат:
салицилат
хлорангидрид фенилсалицилат
натрия
салициловой кислотыФенилсалицилат входит в состав фарм. препаратов.
Салициловая кислота, фарм. препараты на её основе
Слайд 52
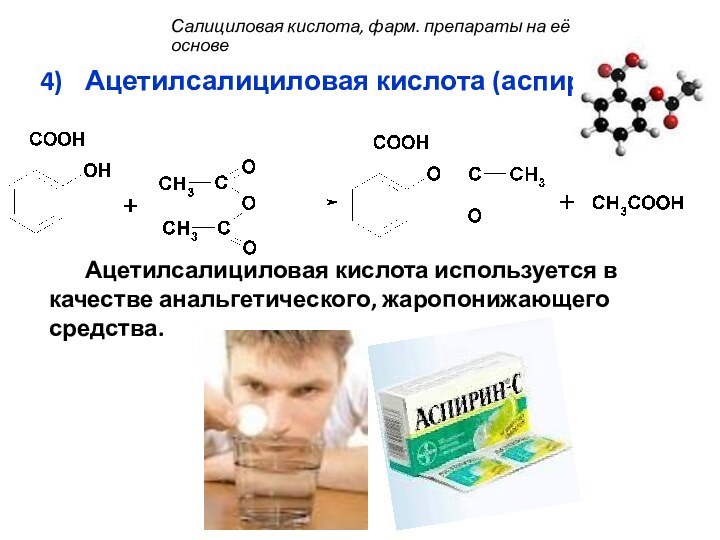
Ацетилсалициловая кислота (аспирин):
Ацетилсалициловая кислота используется в качестве анальгетического,
жаропонижающего средства.
Салициловая кислота, фарм. препараты на её основе
Слайд 53 Салициловая кислота и её производные со свободной гидроксильной
группой дают с раствором хлорида железа (III) фиолетовое окрашивание,
характерное для фенолов, что используется в качественном анализе.Салициловая кислота, фарм. препараты на её основе





























