- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Металлы первой группы и их биологическая роль
Содержание
- 2. Общая характеристика Название «щелочные» было дано из-за
- 3. Строение атома
- 4. Li2O Al2O3 4SiO2 - сподумен
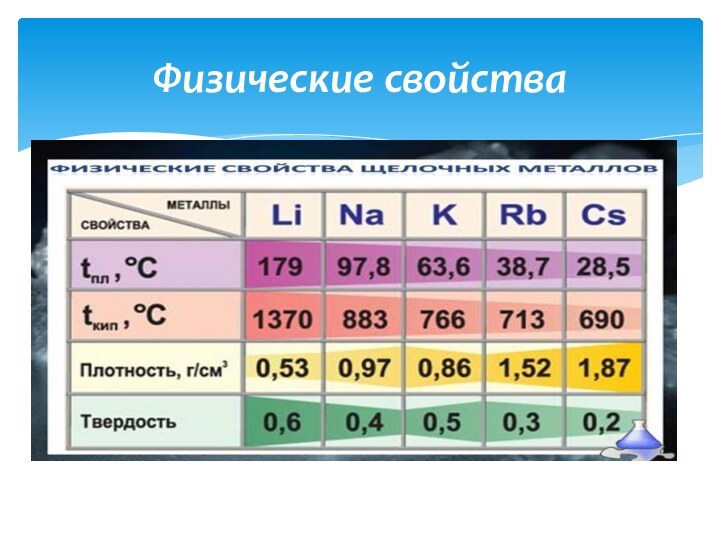
- 5. Серебристо-белого цвета, очень мягкие, легко режутся ножом. Физические свойства
- 6. Катионы щелочных металлов окрашивают пламя газовой горелки в разные цвета.Качественное обнаружение
- 7. 1. Кристаллы их солей и бинарных соединений-
- 8. При сгорании на воздухе ЩМe образуют соединения
- 9. На холоду все щелочные металлы образуют оксиды
- 10. Пероксиды и надпероксиды являются очень сильными окислителями
- 11. Щелочные Ме образуют бинарные соединения- нитриды M3N,
- 12. Ионы натрия и калия играют большую биологическую
- 13. Натрий применяется в органическом синтезе. Служит теплоносителем
- 14. Скачать презентацию
- 15. Похожие презентации
Общая характеристика Название «щелочные» было дано из-за способности этих металлов образовывать щелочи при растворении их в воде. Атомы этих металлов имеют всего один электрон на внешнем энергетическом уровне, и они с лёгкостью его отдают. Поэтому являются













Слайд 4
Li2O Al2O3 4SiO2 - сподумен
NaCl
- каменная соль
Na2SO4 10H2O - глауберова соль (мирабилит)
NaNO3 -
чилийская селитраKCl NaCl - сильвинит
KCl MgCl2 6H2O - карналлит
K2O Al2O3 6SiO2 - полевой шпат (ортоклаз)
Рубидий и цезий – редкие элементы.
Франций – радиоактивный элемент
Содержание в природе.
Слайд 6 Катионы щелочных металлов окрашивают пламя газовой горелки в
разные цвета.
Качественное обнаружение
Слайд 7
1. Кристаллы их солей и бинарных соединений- ионные;
2.В
свободном виде проявляют высокую восстановительную активность;
3.Их оксиды и гидроксиды
имеют сильнощелочной характер;4.Получение щелочных металлов возможно только путем электролиза расплава их галогенидов или гидроксидов.
Химические свойства щелочных металлов.
Слайд 8 При сгорании на воздухе ЩМe образуют соединения с
увеличивающимся содержанием кислорода от Li к Cs.
4Li + O2
= 2Li2O2Na + O2 = Na2O2
K + O2 = KO2
Rb + O2 = RO2
Cs + O2 = CsO2
Взаимодействие с простыми веществами.
Слайд 9 На холоду все щелочные металлы образуют оксиды М2О,
которые являются типичными основными оксидами и при взаимодействии с
водой образуют щелочи.М2О + Н2О = 2МОН
Оксиды, гидроксиды.
Слайд 10 Пероксиды и надпероксиды являются очень сильными окислителями за
счет избыточного кислорода.
Na2O2 + CO = Na2CO3
NA2O2 + 2H2SO4
+ 2NaI= I2 + 2H2O + 2Na2SO42KO2 + S = K2SO4
2KO2 + 2NH3 = 2KOH+ N2 + 2H2O
Слайд 11 Щелочные Ме образуют бинарные соединения- нитриды M3N, карбиды
М2С2 и гидриды МН. Все они энергично разлагаются водой:
Li3N
+ 3H2O = 3LiOH + NH3Na2C2 + 2H2O = 2NaOH + C2H2
KH +H2O + KOH + H2
Слайд 12 Ионы натрия и калия играют большую биологическую роль:
Nа+ — главный внеклеточный ион, содержится в крови и
лимфе, а К+ — основной внутриклеточный ион. Они выполняют разные функции в организме, но предпочитают «работать» вместе. Соотношение концентраций этих ионов регулирует давление крови в живом организме и обеспечивает перемещение растворов солей из корней в листья растений.Самая значительная способность калия — поддерживать работу сердечной мышцы, поэтому нехватка калия в организме очень сказывается на здоровье человека. Калий необходим для всех растений, при его недостатке снижается интенсивность фотосинтеза растений.
Биологическая роль
Слайд 13 Натрий применяется в органическом синтезе. Служит теплоносителем в
ядерных реакторах вместе с калием. Газообразный Na – наполнитель
желтосветных ламп наружного освещения. Калий- в производстве жидких мыл, стекольном производстве. Неорганические соли лития применяют в пиротехнике, химической, фармацевтической, текстильной промышленности, а также в медицине для лечения психических расстройств.Рубидий и его соединения применяют в производстве катодов для фотоэлементов, в качестве добавок в газовую среду неоновых и аргоновых светильников.
Цезий и его соединения применяют в радиотехнике, приборостроении, в производстве аккумуляторов.
Применение