- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему НЕМЕТАЛЛЫ природные соединения применения продуктов их переработки
Содержание
- 2. Элементы в природе.
- 3. Нахождение в природе.Самородные элементыСера Графит САлмаз САзот и кислород, инертные газы в составе воздуха
- 4. Нахождение в природе← Апатиты РГалит NaCl →← FeS2 пиритКварц SiO2 →
- 5. Неметаллы - это химические элементы, которые могут
- 6. Соединения неметаллов.Оксиды – только кислотные SO3,
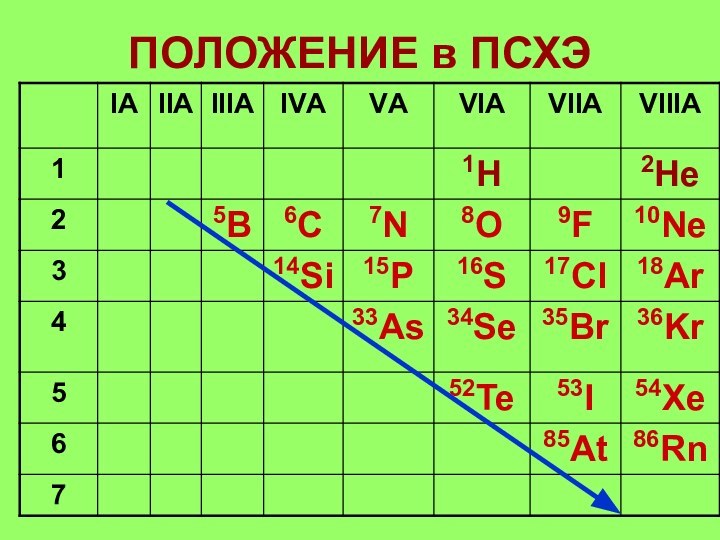
- 7. ПОЛОЖЕНИЕ в ПСХЭ
- 8. ЭЛЕМЕНТЫ - IA,IIIA,IVAН
- 9. ПНИКТОГЕНЫ -VA
- 10. ХАЛЬКОГЕНЫ -VIA
- 11. ГАЛОГЕНЫ -VIIA
- 12. ИНЕРТНЫЕ ГАЗЫ-VIIIA
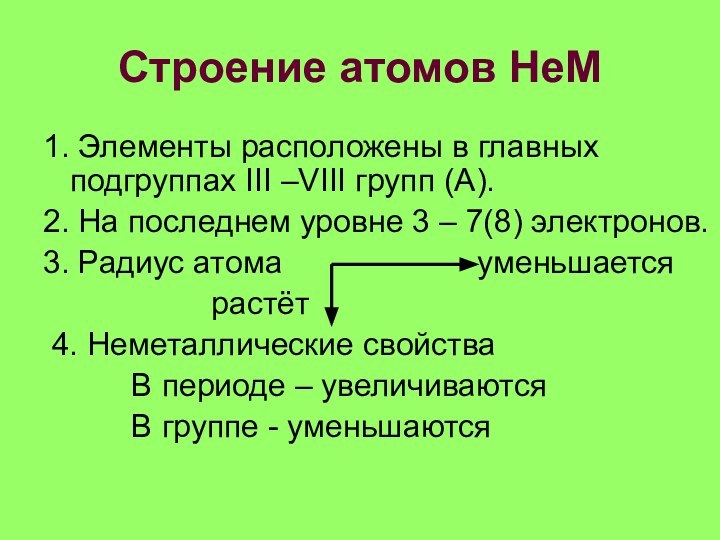
- 13. Строение атомов НеМ1. Элементы расположены в главных
- 14. Строение атомов НеМ5. Высокая электроотрицательность.6. Принимают электроны
- 15. Физические свойстваАгрегатное состояние.Газообразные – азот, кислород, хлор,
- 16. Строение неметаллов. Молекулярное (НеМ), где Инертные газы
- 17. Кислород, водород – пример газообразных бесцветных неметаллов
- 18. Большинство неметаллов имеют твёрдое агрегатное состояниеСера – кристаллическое вещество жёлтого цветаКрасный фосфорУглерод (уголь)
- 19. Неметаллы малорастворимы в водеУголь ФосфорСера не смачивается водой
- 20. Скачать презентацию
- 21. Похожие презентации
Элементы в природе.

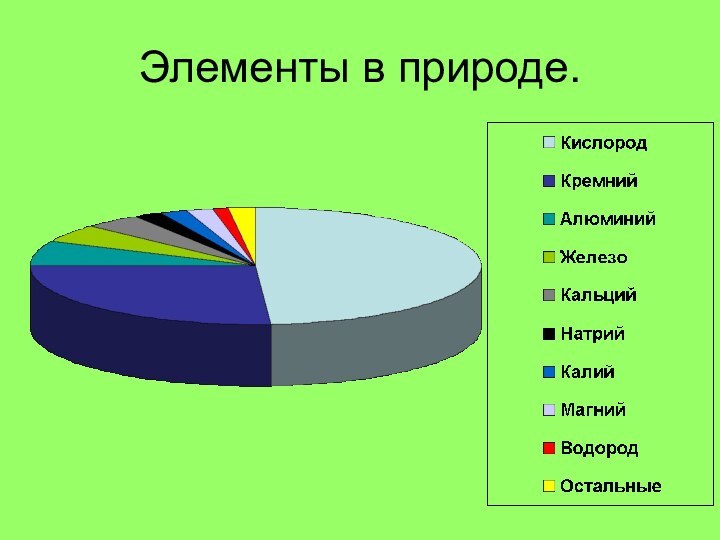
















Слайд 3
Нахождение в природе.
Самородные элементы
Сера
Графит С
Алмаз С
Азот и
кислород, инертные газы в составе воздуха
Слайд 5 Неметаллы - это химические элементы, которые могут проявлять
свойства как окислителя ( принимают электроны), так и восстановителя
(отдают электроны).НеМ – элементы с высокой ОЭО (2 - 4)
Исключения : фтор – только окислитель,
инертные газы – могут только отдавать электроны.
Гелий, неон и аргон – соединений не образуют.
Слайд 6
Соединения неметаллов.
Оксиды – только кислотные
SO3, SO2,
CO2 и другие.
(кроме NO и CO –безразличные)
Гидроксиды –
только кислотыH2SO4, H2SO3,H2CO3 и другие
Образуют летучие соединения с водородом HCl, NH3…
Слайд 13
Строение атомов НеМ
1. Элементы расположены в главных подгруппах
III –VIII групп (А).
2. На последнем уровне 3 –
7(8) электронов.3. Радиус атома уменьшается
растёт
4. Неметаллические свойства
В периоде – увеличиваются
В группе - уменьшаются
Слайд 14
Строение атомов НеМ
5. Высокая электроотрицательность.
6. Принимают электроны и
отдают.
7. НеМ → кислотный оксид→кислота
8. Летучие водородные соединения
(кислоты, основания и безразличные)
Слайд 15
Физические свойства
Агрегатное состояние.
Газообразные – азот, кислород, хлор, инертные
газы, водород.
Жидкий – бром,
Твёрдые – сера, фосфор, углерод…
Растворимость
в воде.Нерастворимы.
Отношение к электрическому току.
Неэлектропроводные: сера, кислород…
Проводники: графит
Полупроводники: кремний
Слайд 16
Строение неметаллов.
Молекулярное (НеМ), где
Инертные газы He, Ar,
Ne…
H2, Cl2, N2…
P4 белый
Pn красный
Атомное строение
(С)n -алмаз, графит;
(Si)n кремний;
(B)n бор





























