- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Неметаллы.Применение неметаллов
Содержание
- 2. Неметаллы– это химические элементы, которые образуют в
- 3. Физические свойстваЭлементы-неметаллы образуют простые вещества, которые при
- 4. Применение неметаллов
- 5. Химические свойства 1. Окислительные свойства неметаллов проявляются
- 6. СераСера является жизненно важным элементом для живых
- 7. Азот Азот используют для наполнения электролампочек, создания
- 8. ФосфорФосфор в организме является источником энергии. В
- 9. Алмаз Алмаз для сверления твердых пород, изготовления
- 11. ГрафитГрафит для изготовления огнеупорных тиглей, синтетических алмазов,
- 12. УгольУголь для выплавки чугуна и стали, производство
- 13. Хлор Хлор применяют для производства соляной кислоты,
- 14. КремнийКремний в электронике и электротехнике для изготовления
- 15. Кварц Кварц очень мало расширяется при нагревании,
- 16. ВодородВодород используется в химической промышленности для синтеза
- 17. Бром и йод Бром и йод используют
- 18. Скачать презентацию
- 19. Похожие презентации
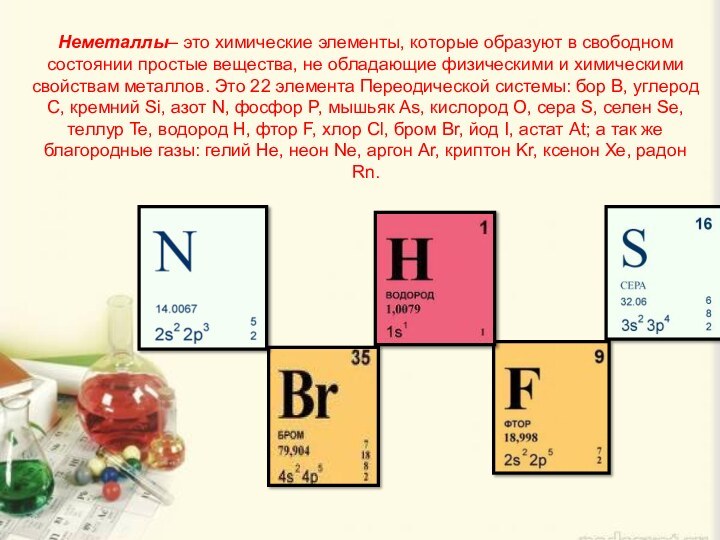
Неметаллы– это химические элементы, которые образуют в свободном состоянии простые вещества, не обладающие физическими и химическими свойствам металлов. Это 22 элемента Переодической системы: бор B, углерод C, кремний Si, азот N, фосфор P, мышьяк As, кислород
















Слайд 3
Физические свойства
Элементы-неметаллы образуют простые вещества, которые при обычных
условиях существуют в разных агрегатных состояниях: газы (благородные газы:He,
Ne, Ar, Kr, Xe, Rn;водород H2, кислород O2, азот N2, фтор F2, хлор Cl2.), жидкость (бром Br2) , твердые вещества( йод I2, углерод C, кремний Si, сера S, фосфор P и др.). Атомы неметаллов образуют менее плотно упакованную структуру чем металлы, в которой между атомами существуют ковалентные связи. В кристаллической решетке неметаллов, как правило, нет свободных электронов. В связи с этим твердые вещества-неметаллы в отличие от металлов плохо проводят тепло и электричество, не обладают пластичностью.
Слайд 5
Химические свойства
1. Окислительные свойства неметаллов проявляются при
взаимодействии с металлами
4Al + 3C = Al4C3
2. Неметаллы
играют роль окислителя при взаимодействии с водородом H2 + F2 = 2HF
3 Любой неметалл выступает в роли окислителя в реакциях с теми металлами, которые имеют низкую ЭО
2P + 5S = P2S5
4. Окислительные свойства проявляются в реакциях с некоторыми сложными веществами
CH4 + 2O2 = CO2 + 2H2O
5. Неметаллы могут играть роль окислителя в реакциях со сложными веществами
2FeCl2 + Cl2 = 2FeCl3 6. Все неметаллы выступают в роли восстановителей при взаимодействии с кислородом
4P + 5O2 = 2P2O5
7. Многие неметаллы выступают в роли восстановителей в реакциях со сложными веществами-окислителями
S + 6HNO3 = H2SO4 + 6NO2 + 2H2O
8. Наиболее сильные восстановительные свойства имеют углерод и водород
ZnO + C = Zn + CO;
CuO + H2 = Cu + H2O
9. Существуют и такие реакции, в которых один и тот же неметалл является одновременно и окислителем, и восстановителем. Это реакции самоокисления-самовосстановления (диспропорционирования)
Cl2 + H2O =HCl + HClO