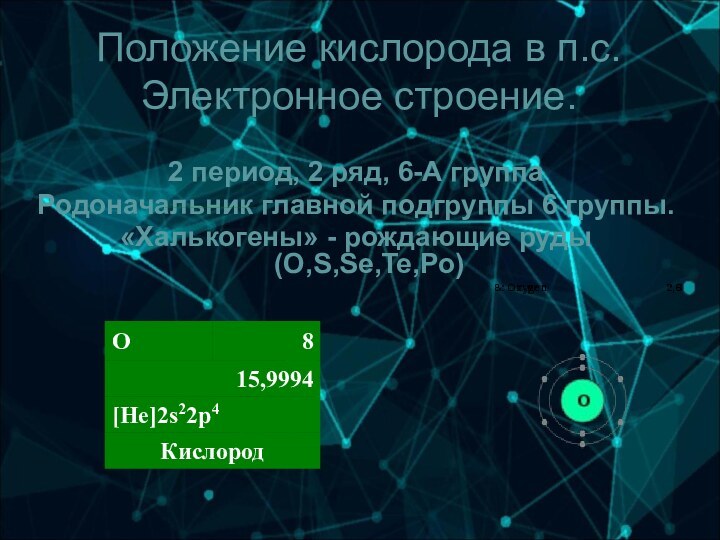
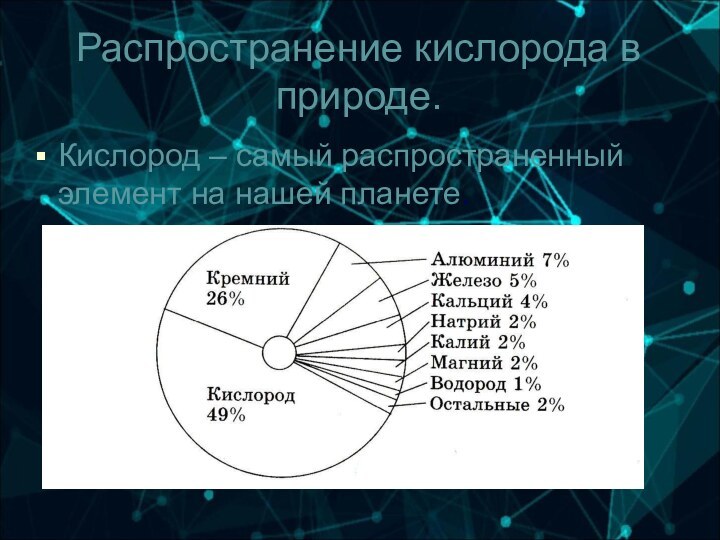
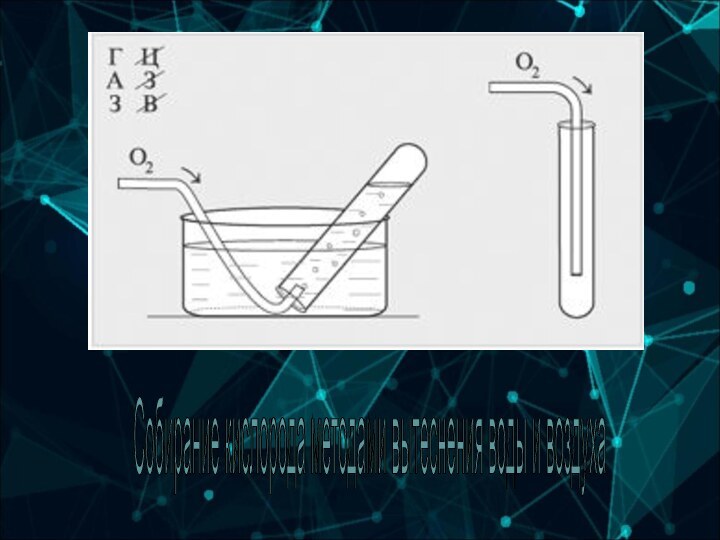
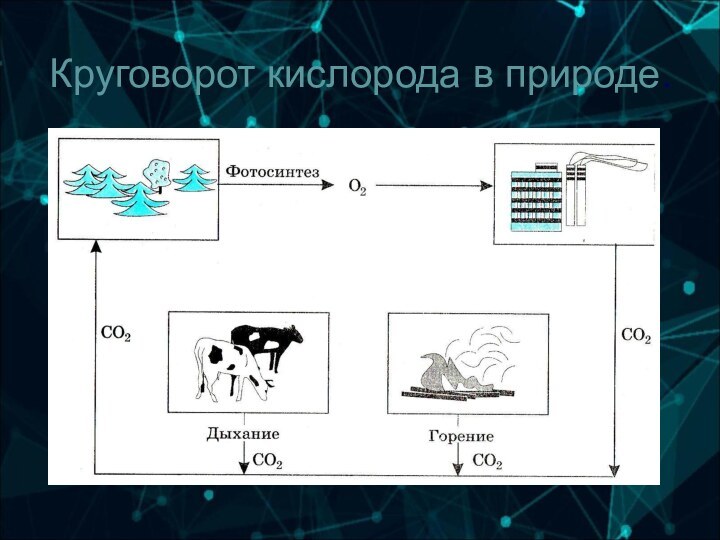
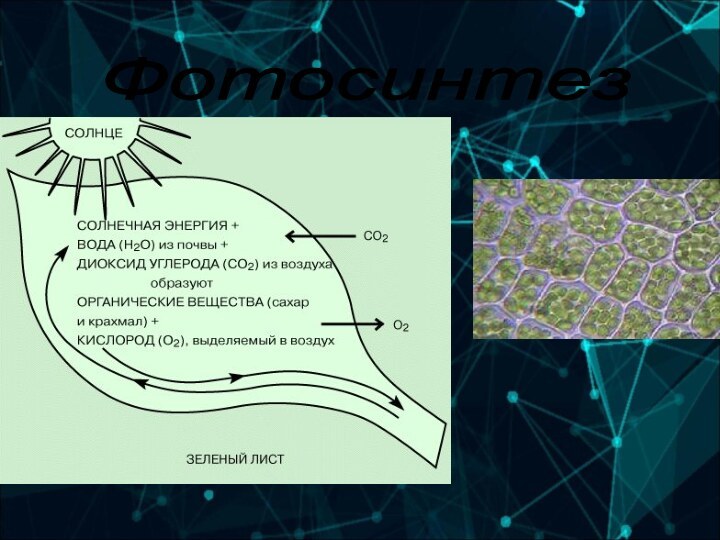
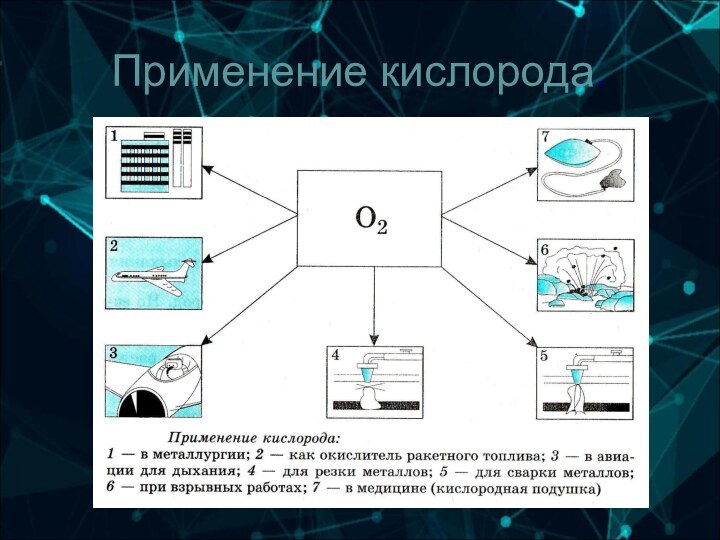
6-А группа
Родоначальник главной подгруппы 6 группы.
«Халькогены» - рождающие
руды (O,S,Se,Te,Po)
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Email: Нажмите что бы посмотреть