- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему
Содержание
- 2. ЦЕЛЬ УРОКА:ПОВТОРИТЬ И ОБОБЩИТЬ ЗНАНИЯ УЧАЩИХСЯ О
- 3. Вопросы для повторенияЧто изучает химия?Что такое химические превращения или химические реакции?Каковы признаки химических реакций?
- 4. ГОРЕНИЕ СВЕЧИПризнак химической реакции: выделение тепла и света
- 5. Реакция между раствором хлорида кальция и раствором щелочи.Признак химической реакции:выпадение белого осадка.
- 6. Действие индикаторов на растворы кислоты, щелочи и воды.Признак химической реакции:изменение окраски индикатора.
- 7. Реакция между раствором перманганата калия и раствором хлорида хрома (II)Признак химической реакции:выпадение зеленого осадка.
- 8. Реакция между раствором хлорида железа (III) и раствором щелочи.Признак химической реакции:выпадение бурого осадка.
- 9. ГОРЕНИЕ СТАЛЬНОЙ ПРОВОЛОКИ В КИСЛОРОДЕПризнак химической реакции: выделение тепла и света
- 10. РЕАКЦИЯ МЕДИ С АЗОТНОЙ КИСЛОТОЙПризнак химической реакции: выделение бурого газа
- 11. Условия, необходимые для осуществления химической реакции:Соприкосновение веществПеремешивание веществОпределенная температура
- 12. Вопросы для повторенияЧто такое химическое уравнение? Какие
- 13. Типы химических реакций: Соединение РазложениеЗамещение Обмен
- 14. Реакция соединения. АВ+Реакция соединения -это реакция,
- 15. Реакция соединения. CuO2+Реакция соединения -это реакция,
- 16. Реакция разложенияАВ+Реакция разложения - это реакция,
- 17. Реакция разложенияH2O2+Реакция разложения - это реакция,
- 18. Реакция замещенияА +ВС Реакция
- 19. Реакция замещенияFe +HCl Реакция
- 20. Реакция обменаAВ+СДРеакция обмена - это реакция, при которой два сложных вещества обмениваются своими составными частями.
- 21. Реакция обменаAgNO3+HClРеакция обмена - это реакция, при которой два сложных вещества обмениваются своими составными частями.
- 22. С какими типами химических реакций мы сегодня
- 23. Определите типы реакций
- 24. Определите типы реакцийCu + CI2 → CuCI2 2Fe + 3CI2 → 2FeCI3
- 25. Определите типы реакцийвидео
- 26. Определите типы реакцийSiO2 + Mg → MgO + SiSiO2 + 2Mg → 2MgO + SiРеакция замещения
- 27. ЗАДАНИЕ №2. Определить тип химической реакции++Реакция замещения
- 28. Игра «ТРЕТИЙ ЛИШНИЙ-1»1. 2NaCl = 2Na +
- 29. Игра «ТРЕТИЙ ЛИШНИЙ-2»1.2CuO + C = 2Cu
- 30. ЗАДАНИЕЦарь зовет к себе Стрельца - удалого
- 31. AI + S = AI2S3 2AI + 3S = AI2S3 реакция соединения
- 32. Лабораторная работа
- 33. Техника безопасности
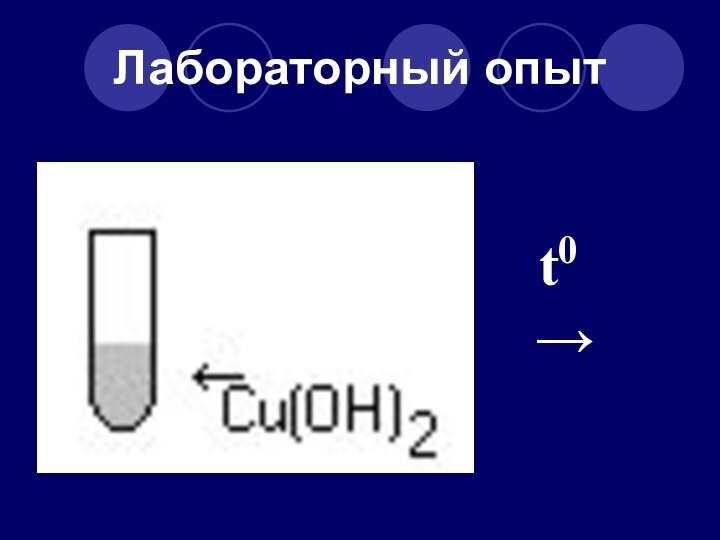
- 34. Лабораторный опыт
- 35. Напишите уравнение реакции и определите тип реакцииCuSO4
- 36. Лабораторный опыт t0 →
- 37. Напишите уравнение реакции и определите тип реакции
- 38. Проверочная работа
- 39. Задание № 1 Расставьте коэффициенты и определите тип реакции в следующих уравнениях реакций:
- 40. 1 вариантРасставьте коэффициенты и определите тип реакции
- 41. 2 вариантРасставьте коэффициенты и определите тип реакции
- 42. 1 вариант2. Приведены схемы реакций. Составьте уравнения химических
- 43. 2 вариант2. Приведены схемы реакций. Составьте уравнения химических
- 44. 1 вариант3. Выберите на ваш взгляд, правильный ответ.
- 45. 2 вариант3. Выберите на ваш взгляд, правильный ответ.
- 46. Проверка выполненной работы
- 47. 1 вариантА) 2Cu + O2 =
- 48. 2 вариантА) 2Ва + O2 =
- 49. Домашнее задание:§ 29; § 30, упр. 1
- 50. Что вам сегодня понравилось на уроке?
- 51. Скачать презентацию
- 52. Похожие презентации
ЦЕЛЬ УРОКА:ПОВТОРИТЬ И ОБОБЩИТЬ ЗНАНИЯ УЧАЩИХСЯ О ХИМИЧЕСКИХ ПРЕВРАЩЕНИЯХ, ПРИЗНАКАХ И ТИПАХ ХИМИЧЕСКИХ РЕАКЦИЙ. ЗАКРЕПИТЬ НАВЫКИ СОСТАВЛЕНИЯ ХИМИЧЕСКИХ УРАВНЕНИЙ. ПРОДОЛЖИТЬ ФОРМИРОВАНИЕ ПРАКТИЧЕСКИХ НАВЫКОВ ПРИ ВЫПОЛНЕНИИ ЛАБОРАТОРНЫХ ОПЫТОВ.


















































Слайд 3
Вопросы для повторения
Что изучает химия?
Что такое химические превращения
или химические реакции?
Каковы признаки химических реакций?
Слайд 5
Реакция между раствором хлорида кальция и раствором щелочи.
Признак
химической реакции:
выпадение белого осадка.
Слайд 6 Действие индикаторов на растворы кислоты, щелочи и
воды.
Признак химической реакции:
изменение окраски индикатора.
Слайд 7 Реакция между раствором перманганата калия и раствором хлорида
хрома (II)
Признак химической реакции:
выпадение зеленого осадка.
Слайд 8 Реакция между раствором хлорида железа (III) и раствором
щелочи.
Признак химической реакции:
выпадение бурого осадка.
Слайд 11
Условия, необходимые для осуществления химической реакции:
Соприкосновение веществ
Перемешивание веществ
Определенная
температура
Слайд 12
Вопросы для повторения
Что такое химическое уравнение?
Какие реакции
называются реакциями соединения?
Какие реакции называются реакциями разложения?
Какие реакции называются
реакциями замещения? Какие реакции называются реакциями обмена?
Слайд 14
Реакция соединения.
А
В
+
Реакция соединения -это реакция, при
которой из двух или нескольких простых веществ образуется одно
сложное вещество.
Слайд 15
Реакция соединения.
Cu
O
2
+
Реакция соединения -это реакция, при
которой из двух или нескольких простых веществ образуется одно
сложное вещество.
Слайд 16
Реакция разложения
А
В
+
Реакция разложения - это реакция, при
которой одно сложное вещество распадается на два или несколько
простых или сложных веществ.
Слайд 17
Реакция разложения
H2
O
2
+
Реакция разложения - это реакция, при
которой одно сложное вещество распадается на два или несколько
простых или сложных веществ.
Слайд 18
Реакция замещения
А
+
В
С
Реакция замещения
-это реакция, при которой атомы простого вещества замещают атомы
в сложном веществе
Слайд 19
Реакция замещения
Fe
+
H
Cl
Реакция замещения
-это реакция, при которой атомы простого вещества замещают атомы
в сложном веществе2
2
Слайд 20
Реакция обмена
A
В
+
С
Д
Реакция обмена - это реакция, при которой
два сложных вещества обмениваются своими составными частями.
Слайд 21
Реакция обмена
Ag
NO3
+
H
Cl
Реакция обмена - это реакция, при которой
два сложных вещества обмениваются своими составными частями.
Слайд 22
С какими типами химических реакций мы сегодня познакомились?
Соединение
Разложение
Замещение
Обмен
Слайд 28
Игра «ТРЕТИЙ ЛИШНИЙ-1»
1. 2NaCl = 2Na + Cl2
2.
CaO + CO2 = CaCO3
3. C + O2 =CO2
Ответ:
2NaCl
= 2Na + Cl2
Слайд 29
Игра «ТРЕТИЙ ЛИШНИЙ-2»
1.2CuO + C = 2Cu +
O2
2. 2NO + O2 = 2NO2
3. Mg +H2S =
MgS + H2Ответ:
2NO + O2 = 2NO2
Слайд 30
ЗАДАНИЕ
Царь зовет к себе Стрельца - удалого молодца
И дает ему поручение государственного значения:
«Чтоб я стал очень
богат, нужен мне алюминия
сульфидНочь даю тебе подумать, утром буду ждать доклад!
Не смогешь – кого винить? Должен я тебя казнить.
Запиши себе названье, чтоб со страху не забыть».
Напишите уравнение реакции получения сульфида алюминия.
Укажите тип реакции.
Слайд 35
Напишите уравнение реакции и определите тип реакции
CuSO4 +
NaOH → Cu(OH)2 + Na2SO4
CuSO4 + 2NaOH → Cu(OH)2
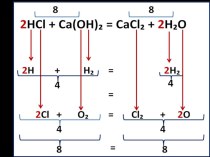
+ Na2SO4Тип реакции – реакция обмена
Слайд 37
Напишите уравнение реакции и определите тип реакции
t0
Cu(OH)2 → CuO + H2OТип реакции – реакция разложения
Слайд 39
Задание № 1
Расставьте коэффициенты и определите тип реакции
в следующих уравнениях реакций:
Слайд 40
1 вариант
Расставьте коэффициенты и определите тип реакции в
следующих уравнениях реакций:
А) Cu + O2 =; Б) NaOH
+ HNO3 =;В) H2 + CuO =; Г) Ag2O =;
Д) MgO + HF=.
Слайд 41
2 вариант
Расставьте коэффициенты и определите тип реакции в
следующих уравнениях реакций: А) Ва + O2 =; Б) KOH
+ H3PO4 =;В) H2 + FeO =; Г) HgO =;
Д) BaO + HBr =.
Слайд 42
1 вариант
2. Приведены схемы реакций. Составьте уравнения химических реакций,
расставьте коэффициенты и укажите их тип: а) нитрат серебра +
хлорид железа (III) → → хлорид серебра + нитрат железа (III); б) гидроксид свинца (II) → оксид свинца (II) + вода.
Слайд 43
2 вариант
2. Приведены схемы реакций. Составьте уравнения химических реакций,
расставьте коэффициенты и укажите их тип: а) нитрат бария +
сульфат натрия → → сульфат бария + нитрат натрия; б) оксид лития + вода → гидроксид лития.
Слайд 44
1 вариант
3. Выберите на ваш взгляд, правильный ответ.
В
реакциях обмена могут образоваться: а) несколько простых веществ; б) два сложных
вещества; в) одно сложное вещество; г) одно простое вещество.
Слайд 45
2 вариант
3. Выберите на ваш взгляд, правильный ответ.
В
реакции замещения могут вступать: а) одно простое и одно сложное
вещество; б) одно сложное вещество; в) несколько простых веществ; г) несколько сложных веществ.
Слайд 47
1 вариант
А) 2Cu + O2 = 2CuO
– соединение Б) NaOH + HNO3 = NaNO3 + H2O
– обмен В) Н2 + FeO = Fe + Н2O - замещение Г) 2Ag2O= 4Ag + O2 – разложение Д) MgO + 2HF = MgF2 + H2O - обменА) 3AgNO3 + FeCI3 = 3AgCI +Fe(NO3)3 (обмен) Б) Pb(OH)2 = PbO + H2O (разложение)
Ответ: Б
Слайд 48
2 вариант
А) 2Ва + O2 = 2ВаO
– соединение Б) 3КOH + H3РО4 = К3РO4 + 3H2O
– обмен В) H2 + FeO = Fe +H2O – замещение Г) 2HgO= 2Hg + O2 – разложение Д) ВаO + 2HВr = BaBr2 + H2O - обменА) Ва(NO3)2 + FeCI 3 = 3AgCI +Fe(NO3)3 (обмен) Б) Li2O + H2O = 2LiOH (соединение)
Ответ: А