- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему по теме Соли (8 класс)
Содержание
- 2. Содержание1). Определение.
- 3. Определение. Формулы.
- 4. Соли соляной кислоты НСl - хлориды Соли
- 6. Средними или нормальными солями – называют
- 7. Основными солями называют соли, в молекулах
- 9. 5). Взаимодействие кислотного оксида с основным оксидом:
- 10. 9). Взаимодействие металла с неметаллом:
- 11. Взаимодействие хлора с
- 15. 3). Соли реагируют со щелочами:
- 16. Взаимодействие металлов с солями
- 19. В огне я воду испаряю,В воде я
- 20. Скачать презентацию
- 21. Похожие презентации
Содержание1). Определение. Формулы.2). Классификация.3). Способы получения.4). Физические свойства.5). Химические свойства.6). Применение.7). Вопросы для повторения.


















Слайд 3 Определение. Формулы.
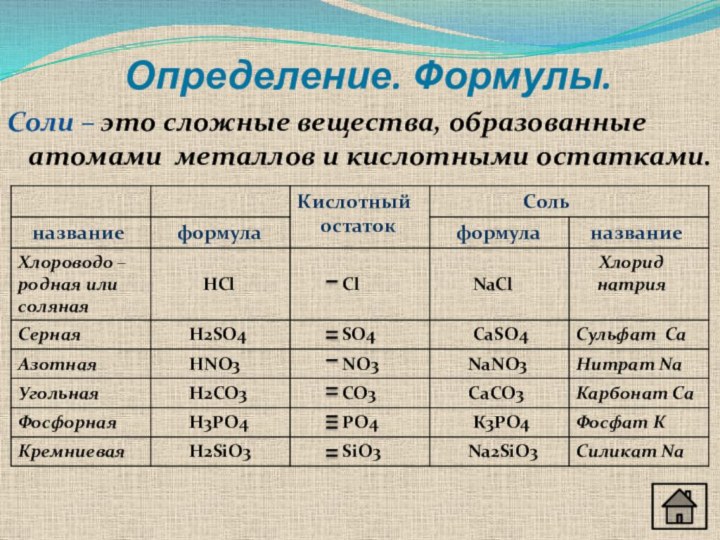
Соли – это сложные вещества, образованные атомами металлов и
кислотными остатками.
Слайд 4
Соли соляной кислоты НСl - хлориды
Соли серной
кислоты H2SO4 - сульфаты
Соли азотной кислоты HNO3 - нитраты
Соли
угольной кислоты Н2СО3 - карбонатыСоли фосфорной кислоты Н3РО4 - фосфаты
Соли кремниевой кислоты H2SiO3 – силикаты
Соли сероводородной кислоты Н2S – сульфиды
Соли сернистой кислоты H2SO3 - сульфиты
Слайд 5
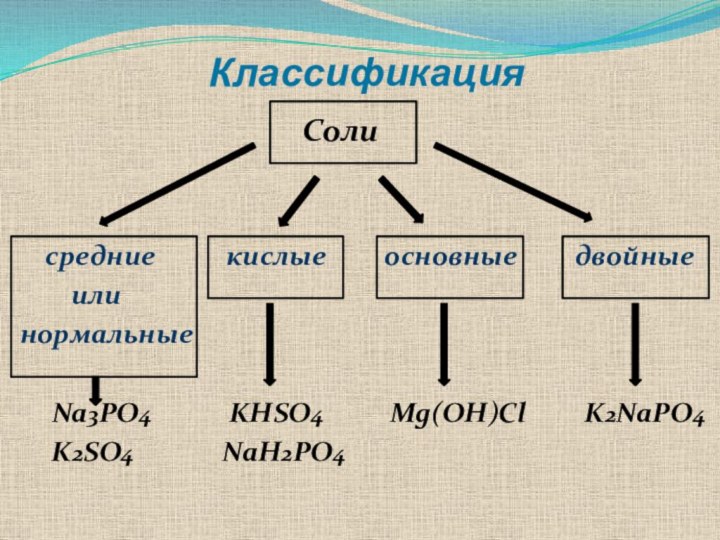
Классификация
Солисредние кислые основные двойные
или
нормальные
Na3PO4 KHSO4 Mg(OH)Cl K2NaPO4
K2SO4 NaH2PO4
Слайд 6
Средними или нормальными солями – называют соли,
которые образуются при замещении атомами металлов всех атомов водорода
в молекулах кислот:H3PO4 + 3NaOH Na3PO4 + 3H2O
Кислыми солями называют соли, которые образуются в результате неполного замещения атомами металлов атомов водорода в молекулах кислот (получаются при избытке кислоты):
H3PO4 + NaOH NaH2PO4 + H2O
Слайд 7
Основными солями называют соли, в молекулах которых,
кроме кислотных остатков, имеются также гидроксогруппы ( получаются при
избытке оснований):Mg(OH)2 + HCl Mg(OH)Cl + H2O
Двойными солями называют соли, которые образуются при замещении атомов водорода в молекулах кислот двумя различными металлами:
H3PO4 + 2KOH + NaOH K2NaPO4 + 3H2O
Слайд 8
Способы получения
1). Действие кислоты на металл:
2HCl + Zn ZnCl2 + H2 2). Взаимодействие кислоты и основного оксида:
H2SO4 + CuO CuSO4 + H2O
3). Взаимодействие кислоты и основания:
HNO3 + KOH KNO3 + H2O
4). Взаимодействие кислотного оксида со щёлочью:
N2O5 + Ca(OH)2 Ca(NO3)2 + H2O
Слайд 9
5). Взаимодействие кислотного оксида с основным оксидом:
t
SiO2 + CaO CaSiO3
6). Взаимодействие соли с кислотой:
AgNO3 + HCl AgCl + HNO3
7). Взаимодействие соли со щёлочью:
FeCl3 + 3KOH Fe(OH)3 + 3KCl
8). Взаимодействие соли с металлом:
СuSO4 + Fe FeSO4 + Cu
Слайд 10
9). Взаимодействие металла с неметаллом:
горение
2Fe + 3Cl2 2FeCl3
10). Взаимодействие двух солей:
Na2SO4 + BaCl2 BaSO4 + 2NaCl
Слайд 13
Физические свойства
Соли – твёрдые вещества разного цвета
с различной растворимостью в воде. Некоторые имеют различный запах и вкус.Слайд 14
Химические свойства
1). Соли реагируют с металлами:
CuSO4 + Fe FeSO4 + Cu Способность металлов вытеснять другой металл из его соли определяется положением металла в ряду активности: более активный металл вытесняет менее активный из его соли.
2). Соли реагируют с кислотами:
Pb(NO3)2 + 2HCl PbCl2 + 2HNO3
Слайд 15
3). Соли реагируют со щелочами:
СuSO4 + 2KOH Cu(OH)2
+ K2SO44). Соли реагируют с солями:
CaCl2 + Na2CO3 CaCO3 + 2NaCl
5). Некоторые соли при нагревании разлагаются:
t
СaCO3 CaO + CO2
6). Некоторые соли способны реагировать с водой и образовывать кристаллогидраты:
СuSO4 + 5H2O = CuSO4 5H2O + Q
белого цвета сине-голубого цвета
Слайд 17
Применение
1). В быту
2). В
медицине3). В промышленности:
Фармацевтической
Химической
Кожевенной
Текстильной
4). В сельском хозяйстве
Слайд 18
Загадки
Я, конечно,
очень нужен.Без меня не сваришь ужин,
Не засолишь огурца,
Не заправишь холодца.
Но не только лишь в еде –
Я живу в морской воде.
Если льёт слеза из глаза,
Вкус припомнишь мой ты сразу.
Кто догадлив, говорит:
Это -
Нaтрия хлорид NaCl
Слайд 19
В огне я воду испаряю,
В воде я камнем
застываю;
Врачу и скульптору я брат,
Но чей, скажите, я сульфат?
Сообщаю:
я спешу! Я живу, пока пишу.
Исчертил всю доску белым…
Исчезаю. Был я …
Сульфат кальция - гипс CaSO4
Мелом СаСО3