+ HCl ? NaCl + H2O
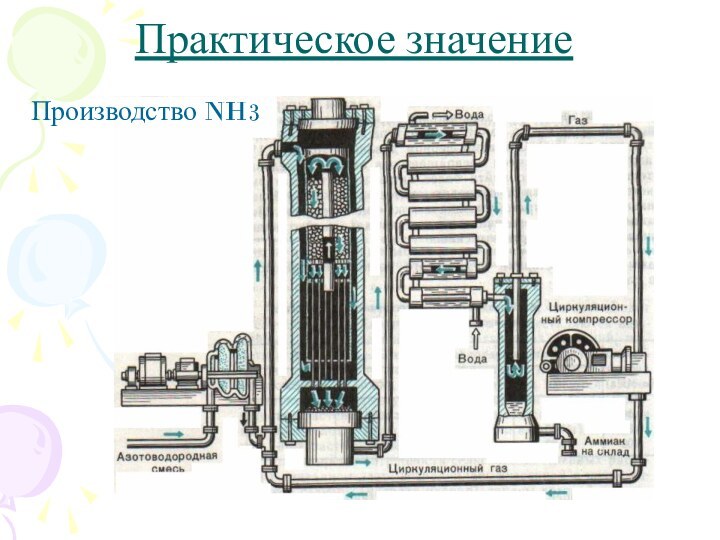
2. N2 + 3H2
? 2NH33. AgNO3 + NaCl ? AgCl + NaNO3
4. SO3 + H2O ? H2SO4
5. CH4 + 2O2 ? CO2 + 2H2O
6. 2SO2 + O2 ? 2SO3
7. HCOOH + CH3OH ? HCOOCH3 + H2O
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Email: Нажмите что бы посмотреть


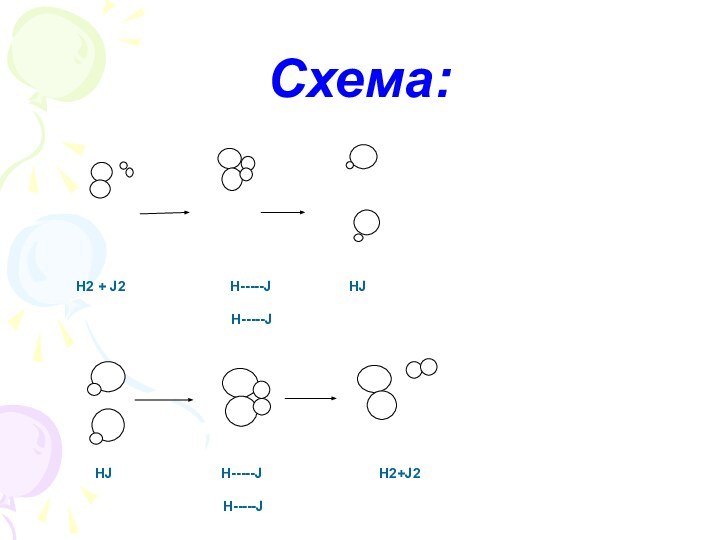
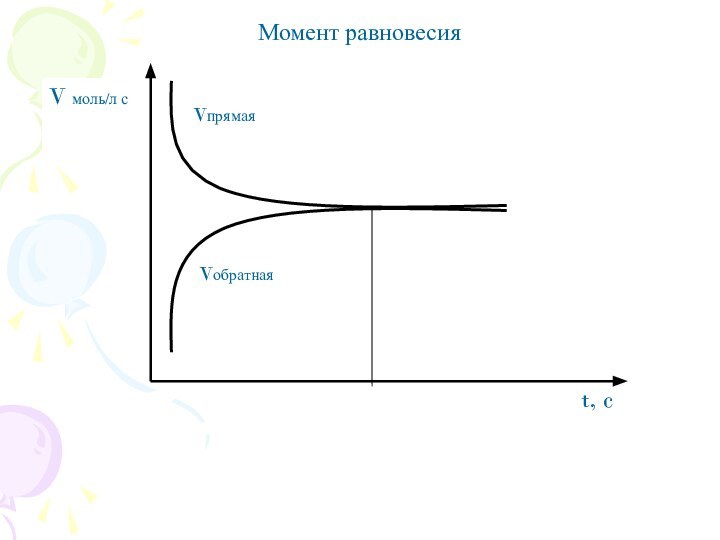
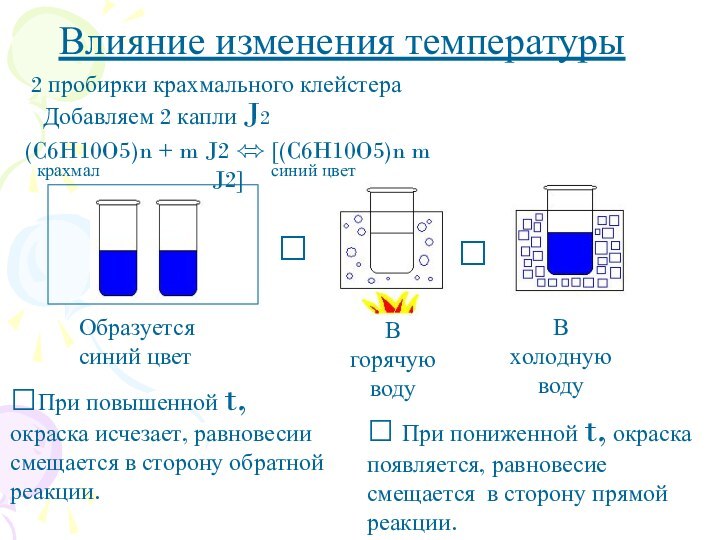





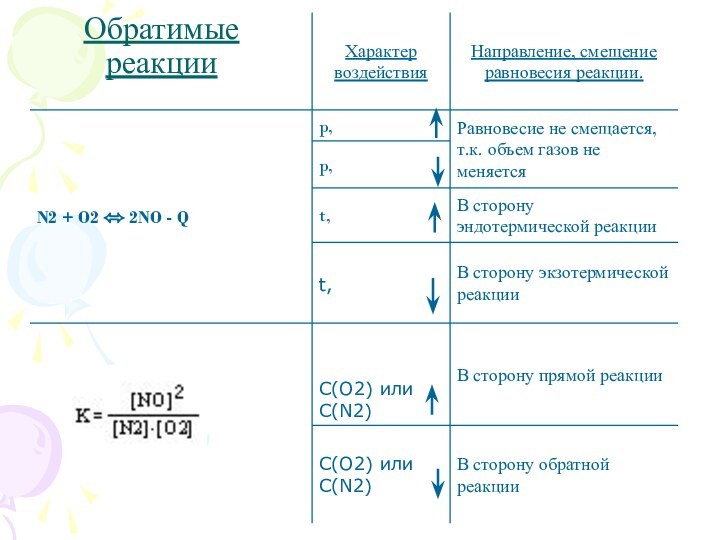
? При пониженной t, окраска появляется, равновесие смещается в сторону прямой реакции.
При сжатии цвет газа стал бледно-желтым, а равновесие сместилось в сторону прямой реакции.
При увеличении давления равновесие смещается в сторону меньшего объема