Слайд 2
Общие методические приемы в оценке качества лекформ
Формы
контроля качества лек средств:
Фармацевтический анализ
Постадийный контроль производства лекарственных средств
Анализ
лекформ индивидуального изготовления
Экспресс-анализ
Биофармацевтический анализ
Слайд 3
Классификация лекформ по агрегатному состоянию
ТВЕРДЫЕ – порошки, таблетки,
драже, сборы, гранулы, капсулы, спансулы, горчичники
ЖИДКИЕ – истинные
и коллоидные растворы, суспензии, эмульсии, капли, линименты, настои и отвары, экстракты, сиропы
МЯГКИЕ – мази, суппозитории, пилюли, капсулы желатиновые, пластыри, пасты
ГАЗООБРАЗНЫЕ – аэрозоли, газы
Слайд 4
Лекформы по содержанию ЛВ различают одно-, двух-, трех-,
четырех- и т.д. компонентные лекарственные смеси. Многокомпонентные содержат несколько
лек. веществ.
Лекформы содержат также стабилизаторы, антибактериальные добавки, наполнители, вспомогательные вещества…
При анализе многокомпонентных ЛФ:
Выбор условий
Разделение веществ
Слайд 5
МОДЕЛЬНЫЕ СМЕСИ – готовят с использованием аналитических весов,
добавляют все компоненты по технологическим правилам , выполняют различные
методики фармацевтического анализа, и выбирают ту методику, которая позволяет получить наиболее точные результаты.
КРИТЕРИИ ФАРМ АНАЛИЗА
Избирательность
Точность анализа (воспроизводимость, правильность)
Чувствительность (предел обнаружения)
Фактор времени
Слайд 6
Система контроля качества в условиях химико-фармацевтического предприятия
При производстве
готовых лекарственных средств (ГЛС) должно быть обеспечено надлежащее производство
и контроль качества на всех этапах производства ГЛС.
Фарм предприятие должно гарантировать что разработка, испытания и изготовление ЛС проведены с учетом требований GLP, GCP и GMP.
Слайд 7
НАЦИОНАЛЬНЫЙ СТАНДАРТ
РОССИЙСКОЙ ФЕДЕРАЦИИ
ГОСТ Р 52249-2009 «Правила организации
производства и контроля качества ЛС» (Российские национальные GMP)
Стандарт распространяется
на все виды ЛС и устанавливает общие требования к их производству и контролю качества, а также специальные требования к производству активных фармацевтических субстанций и отдельных видов ЛС.
Слайд 8
Минпромторг утвердил Правила организации производства и контроля качества
лекарств
Приказ Минпромторга России от 14.06.2013 N 916 "Об утверждении
Правил организации производства и контроля качества ЛС" (Зарегистрировано в Минюсте России 10.09.2013 N 29938)
С 1 января 2014 года все предприятия должны перейти на работу по правилам GMP (Good Manufacturing Practice — надлежащей производственной практики).
Это свод правил, который в мельчайших деталях описывает все стороны производственного процесса: от устройства помещений, уровня оборудования, качества воздуха и воды в цехах, квалификации персонала до таких мелочей, как качество униформы и гигиена работников.
Слайд 9
На предприятии-производителе должна быть создана система обеспечения качества,
включающая в себя организацию работы по GMP, контроль качества
и систему анализа рисков.
В процессе производства и контроля качества следует составлять протоколы (заполняемые рукописным способом и/или с применением технических средств), документально подтверждающие фактическое проведение предусмотренных инструкциями технологических стадий и получение продукции требуемого качества в количестве, соответствующем установленным нормам. Все отклонения необходимо расследовать и протоколировать в полном объеме.
Слайд 10
Контроль качества включает в себя отбор проб, проведение
испытаний (анализов) и оформление соответствующей документации. Инструкции по организации,
документированию и выдаче разрешения на выпуск продукции должны включать в себя проведение всех необходимых испытаний и запрещать использование исходного сырья и материалов и реализацию готовой продукции до подтверждения соответствия качества установленным требованиям.
Слайд 11
Для каждого вида продукции должны быть разработаны и
утверждены промышленный регламент и технологические инструкции с указанием размера
серии.
Технологический регламент производства ЛС – НД, устанавливающий научно обоснованный метод производства фармпродукции и обеспечивающий получение ЛС с показателями качества, отвечающими требованиями НД (ФС и ФСП) и ГФ.
Слайд 12
Промышленный регламент – основной документ, нормирующий технологию производства
и контроль качества ЛС, выпускаемых серийно в условиях химико-фармацевтических
предприятий.
Контроль за выполнением требований промышленного регламента возлагается на ОКК (ОТК) предприятия.
Регламент разрабатывается поэтапно.
I. Разработка лабораторного регламента (в условиях научных лабораторий).
Слайд 13
Лабораторный регламент – технологический документ, обобщающий научные исследования
по разработке лабораторного метода получения и контроля качества ЛС.
Лабрегламент является исходным документом для наработки ЛС для проведения доклинических исследований и отработки технологии получения готовой ЛФ, а также используется при проектировании опытно-промышленной установки.
Лабрегламент утверждается руководителем организации-разработчика нового ЛС.
Слайд 14
II. Разработка опытно-промышленного регламента. Документ определяет условия отработки
технологии производства ЛС на опытно-промышленной установке, используемый для производства
опытных образцов (серий) ЛС для проведения клинических исследований и отработки показателей качества ЛС для включения в проект ФС (ФСП).
Утверждается руководителем организации-разработчика и руководителем промышленного предприятия и направляется на согласование в МЗ РФ.
Слайд 15
III. Разработка пускового регламента – позволяет осуществить производство
нового препарата.
IV. Оформление пускового регламента в промышленный – это
НД действующего серийного производства ЛС, разработанный на основании оп.-пром.регламента с учетом дополнений, принятых при отработке на опытно-промышленной установке технологии производства и показателей качества ЛС для включения в проект ФС (ФСП).
Утверждается руководителем промышл. предприятия и направляется на согл. в МЗ РФ.
Слайд 16
ТЕХНИЧЕСКИЙ И АНАЛИТИЧЕСКИЙ КОНТРОЛЬ осуществляется на всех стадиях
производства
Слайд 17
Весь технологический процесс надо проводить в полном соответствии
с утвержденным промышленным peгламентом. В регламенте производства, приводится перечень
важнейших контрольных точек производства, обеспечивающих соблюдение установленного технологического режима.
Под контрольной точкой понимают место, наименование определяемого
параметра, норматив,
техническое средство и метод
его определения.
Слайд 18
Контрольные точки описываются в таких разделах регламента, как
характеристика конечного продукта производства, промежуточные продукты, сырье и материалы;
аппаратурная схема производства и спецификация оборудования; изложение технологического процесса; отходы производства, выбросы в атмосферу, их использование и обезвреживание.
Слайд 19
Перечень контрольных точек производства приводится в регламенте в
виде таблицы, в которую включают только такие контрольные точки,
которые необходимы для обеспечения правильного и безопасного ведения процесса и изменение которых должно оформляться как изменение регламента производства.
Слайд 20
В регламенте изложен точный порядок проведения контроля производства.
Указаны места технологической схемы, в которых осуществляется забор проб
для выполнения анализа; дается перечень параметров для проверки; описываются методы анализа; отражается система контроля качества исходных и промежуточных продуктов, сырья и материалов.
Слайд 21
АНАЛИТИЧЕСКИЙ КОНТРОЛЬ ПРОИЗВОДСТВА
Первый, локальный уровень- обеспечивает контроль
какого-то одного процесса, получение промежуточного продукта.
Второй уровень – обеспечивает
контроль целой стадии процессов получения, очистки, выделения полупродукта.
Третий уровень – дает возможность установить качество конечного продукта,
экономичность производства, затраты. Используют методы, рекомендуемые НД.
Слайд 22
Для надежного осуществления постадийного производственного аналитического контроля должны
быть обеспечены следующие основные требования и условия:
. правильный (оптимальный)
выбор аналитического метода;
. обучение персонала аналитической службы;
. снабжение необходимыми аттестованными и прошедшими поверку приборами определенного класса точности, обеспечение их оперативным и квалифицированным обслуживанием;
. снабжение реактивами определенной квалификации чистоты, лабораторной посудой и т.д.
Слайд 23
ОТДЕЛ КОНТРОЛЯ КАЧЕСТВА
Ответственность за качество ЛС несет отдел
контроля качества ОКК (ОТК).
ОКК осуществляет технический контроль на всех
стадиях от приемки сырья до выпуска и отправки готовой продукции.
Структура ОКК обычно включает несколько лабораторий: химико-аналитическую, биологическую, бактериологическую и др.
Слайд 24
В современных условиях ОКК является структурной единицей в
системе управления качеством, что позволило вывести его из подчинения
производственникам.
Возглавляет отдел Руководитель ОКК, который:
-организует работу лабораторий контроля качества в соответствии с требованиями, предъявляемыми в фармотрасли;
-обеспечивает контроль проведения испытаний, предусмотренных технологическим процессом: проведение анализов входного сырья, упаковочных материалов, продуктов, готовой продукции, воды (очищенной и питьевой), анализов по валидациям и т.д. ;
-разрабатывает СОПы, инструкции, протоколы, досье и другие документы, обеспечивающие контроль качества продукции;
-совместно с Директором по качеству составляет программы обучения персонала лабораторий предприятия.
Слайд 25
В подчинении у Руководителя ОКК находятся лаборатории.
Заведующий
микробиологической лабораторией отвечает за микробиологический контроль в производстве ЛС.
В его обязанности входит:
-подготовка необходимых документов для получения Аттестата аккредитации микробиологической лаборатории и Лицензии на право работы с микроорганизмами (существует 4 группы патогенности);
-разработка соответствующих СОПов;
-проведение испытаний на микробиологическую чистоту проб по входному контролю сырья, материалов, готовой продукции в соответствии с требованиями GMP;
-контроль санитарного состояния предприятия, включая взаимодействие с органами СЭС.
Слайд 26
Заведующий аналитической лабораторией отвечает за химический контроль в
производстве ЛС. В его обязанности входит:
-подготовка необходимых документов для
получения Аттестата аккредитации химико-аналитической лаборатории;
-разработка соответствующих СОПов;
-химический контроль качества субстанций, вспомогательных материалов и веществ;
-химический контроль качества готовых лекарственных средств;
-отработка новых методов анализа для вновь внедряемых препаратов.
Слайд 27
Внутризаводской контроль включает:
Операционный контроль
- Проверка выполнения
технологического регламента
Контроль качества промежуточных продуктов
Проверка санитарного состояния помещений
Качество исходного
сырья, материалов
2) Приемо-сдаточный контроль
- Осуществляется проведение анализа на соответствие всем требованиям НД
Слайд 28
Впервые выпускаемые ЛС особенно тщательно проверяются.
Государственный контроль качества
ЛС включает административные процедуры:
1. проведения экспертизы качества, эффективности
и безопасности ЛС при государственной регистрации;
2. предварительного контроля качества ЛС;
3. выборочного контроля качества ЛС;
4. повторного выборочного контроля качества ЛС;
5. осуществления сбора и анализа информации о нежелательных побочных реакциях (НПР) применения ЛС;
6. осуществления сбора и анализа информации о качестве ЛС.
Слайд 29
Ранее действовал
Приказ Минздравсоцразвития России от 30.10.2006 № 734
«Об
утверждении Административного регламента Федеральной службы по надзору в сфере
здравоохранения и социального развития по исполнению государственной функции по организации проведения экспертизы качества, эффективности и безопасности лекарственных средств»
Слайд 30
ПРИКАЗ
от 7 августа 2015 г. № 5539
ОБ УТВЕРЖДЕНИИ
ПОРЯДКА
ОСУЩЕСТВЛЕНИЯ ВЫБОРОЧНОГО КОНТРОЛЯ КАЧЕСТВА ЛЕКАРСТВЕННЫХ СРЕДСТВ ДЛЯ МЕДИЦИНСКОГО ПРИМЕНЕНИЯ
Зарегистрировано
в Минюсте России 9 октября 2015 г. № 39263
Выборочный контроль качества лекарственных средств осуществляется Федеральной службой по надзору в сфере здравоохранения (Росздравнадзор) и ее территориальными органами
Слайд 31
Выборочный контроль качества ЛС включает в себя:
1) обработку
сведений о сериях, партиях ЛС, поступающих в гражданский оборот
в РФ;
2) отбор образцов ЛС у субъектов обращения ЛС в целях проведения испытаний на соответствие требованиям НД;
3) принятие по результатам проведенных испытаний решения о дальнейшем гражданском обороте соответствующего ЛС;
4) принятие уполномоченным федеральным органом исполнительной власти решения о переводе ЛС на посерийный выборочный контроль качества ЛС в случае повторного выявления несоответствия качества ЛС установленным требованиям и (при необходимости) о проверке субъекта обращения ЛС.
Слайд 32
Росздравнадзор проводит сбор и обработку сведений о сериях,
партиях ЛС, поступающих в гражданский оборот Срок предоставления сведений
не должен превышать 5 рабочих дней после подтверждения уполномоченным лицом отечественного производителя ЛС соответствия серии ЛС требованиям, установленным при их государственной регистрации (разрешение на выпуск), или после выпуска таможенными органами ЛС под определенную таможенную процедуру.
Росздравнадзор предоставляет организациям, осуществляющим производство ЛС в РФ и ввоз ЛС в РФ, авторизованный доступ в подсистему "Выборочный контроль" автоматизированной информационной системы.
(размещаются Росздравнадзором на официальном сайте roszdravnadzor.ru)
Слайд 33
План выборочного контроля качества ЛС формируется Росздравнадзором в
срок до 1 января календарного года,
при этом учитывается следующая
информация:
1) результаты государственного контроля (надзора) в сфере обращения ЛС;
2) результаты выборочного контроля качества ЛС за предыдущие периоды;
3) данные о выявлении недоброкачественных и фальсифицированных ЛС;
4) сведения о качестве ЛС, содержащиеся в обращениях и заявлениях граждан, юр. лиц, индивидуальных предпринимателей, информации от органов гос. власти, органов местного самоуправления, из средств массовой информации о фактах: возникновения угрозы причинения вреда жизни, здоровью граждан.
План выборочного контроля качества ЛС утверждается руководителем Росздравнадзора и публикуется на официальном сайте Росздравнадзора.
Слайд 34
Отбор образцов ЛС в рамках выборочного контроля качества
ЛС осуществляется должностными лицами Росздравнадзора, в присутствии представителя организации,
в которой осуществляется отбор образцов, в соответствии с заданиями Росздравнадзора.
Отбор образцов ЛС оформляется протоколом отбора образцов в 2 экз. в количествах, необходимых для проведения двух испытаний.
Слайд 35
Для проведения испытаний методами неразрушающего анализа отбираются 3
упаковки ЛП или 10 г фармацевтической субстанции.
При совпадении спектров
отобранных образцов ЛС с эталонным спектром, установленным в соответствии с ФС, отобранные образцы ЛС возвращаются субъекту обращения ЛС, у которого они были отобраны для проведения испытаний, с оформлением акта возврата образцов.
При несовпадении спектра ЛС с эталонным спектром осуществляется отбор образцов для проведения испытаний качества ЛС по показателям НД как выше указано.
Слайд 36
Образцы ЛС направляются Росздравнадзором в экспертную организацию с
приложением копий протокола отбора образцов и документов, подтверждающих соответствие
качества ЛС требованиям НД.
По запросу экспертной организации также предоставляют стандартные образцы, необходимые для проведения испытаний ЛС в соответствии с НД.
Проведение испытаний ЛС осуществляется экспертной организацией в срок, не превышающий 40 рабочих дней (срок может быть продлен не более чем на 30 рабочих дней ).
По результатам испытаний экспертной организацией оформляется экспертное заключение, содержащее вывод о соответствии ЛС требованиям НД (положительное или отрицательное).
Слайд 37
Положительное экспертное заключение направляется в Росздравнадзор в течение
3 рабочих дней с момента завершения испытаний ЛС на
соответствие требованиям НД.
Отрицательное экспертное заключение направляется в Росздравнадзор в течение 1 рабочего дня с момента завершения испытаний.
Образцы ЛС хранятся не менее 6 месяцев
затем:
- неудовлетворяющие требованиям НД – подлежат уничтожению+
- удовлетворяющие требованиям НД - возвращаются организациям – производителям по их письменной просьбе
(за исключением образцов, испытания которых проведены методами неразрушающего анализа)
+Постановление Правительства РФ от 3 сентября 2010 г. N 674 "Об утверждении Правил уничтожения недоброкачественных ЛС, фальсифицированных ЛС и контрафактных ЛС"
Слайд 38
При получении отрицательного экспертного заключения Росздравнадзором принимается решение
в форме приказа об изъятии и уничтожении выявленной партии
недоброкачественного и (или) фальсифицированного ЛС, который направляется владельцу ЛС, и оформляется решение о прекращении обращения серии ЛС в целом.
Владелец ЛС в срок, не превышающий 30 рабочих дней со дня принятия решения Росздравнадзором об их изъятии, уничтожении, обязан исполнить решение или сообщить о своем несогласии с ним.
В случае если владелец ЛС не согласен с решением, а также, если он не выполнил решение и не сообщил о принятых мерах, Росздравнадзор обращается в суд.
Слайд 39
При получении отрицательного экспертного заключения Росздравнадзор в соответствии
с законодательством
(от 27 декабря 2002 г. №184-ФЗ "О
техническом регулировании")
1) предписывает субъектам обращения ЛС, которыми ЛС выпущено в гражданский оборот, в течение 10 рабочих дней разработать и согласовать с Росздравнадзором программу мероприятий по предотвращению угрозы причинения вреда жизни и здоровью граждан;
2) оказывает содействие в реализации программы мероприятий и осуществляет контроль за ее выполнением;
3) принимает решение об обращении в суд с иском о принудительном отзыве продукции.
Слайд 40
При повторном выявлении несоответствия качества ЛС установленным требованиям
Росздравнадзором принимается решение о переводе ЛС на посерийный выборочный
контроль качества.
Решение Росздравнадзора публикуется на официальном сайте Росздравнадзора (с соблюдением ограничений).
ЛС, переведенное на посерийный выборочный контроль качества, подлежит испытаниям по всем показателям НД в вышеуказанные сроки (40 дней).
Лекарственное средство снимается Росздравнадзором с посерийного выборочного контроля качества на основании положительных экспертных заключений в отношении не менее трех серий ЛС.
Решение о переводе на выборочный контроль публикуется на официальном сайте Росздравнадзора не позднее 10 рабочих дней с даты получения положительных экспертных заключений.
Слайд 41
При повторном выявлении несоответствия качества ЛС установленным требованиям
руководителем Росздравнадзора (при необходимости) принимается решение о проверке субъекта
обращения ЛС.
Целью проверки является выявление причин поступления в гражданский оборот ЛС, качество которого не соответствует требованиям НД.
При выявлении нарушений Росздравнадзором выдается предписание об устранении выявленных нарушений. В случае невыполнения предписания, выданного Росздравнадзором по итогам осуществления выборочного контроля качества лекарственного препарата, Росздравнадзор принимает решение о приостановлении применения ЛП до устранения выявленных нарушений.
Слайд 42
Выборочный государственный контроль ЛС
выполняется на основании плана выборочного
контроля качества ЛС; в течении 5 дней с даты
наступления очередного этапа – готовится проект-задание.
Выборочный контроль качества ЛС проводится по планам Росздравнадзора сотрудниками инспектората Росздравнадзора, территориальных управлений Росздравнадзора или экспертных организаций в отношении:
- производителей ЛС;
- организаций оптовой торговли ЛС;
- аптечных учреждений.
Планируется увеличить объем выборочного контроля до 10% от выпускаемых серий и шире использовать экспресс-анализ для определения подлинности.
Слайд 43
Для организации выборочного контроля производители и импортеры должны
ежемесячно направлять в Росздравнадзор перечень серий ЛС, выпущенных в
обращение на территории РФ.
Образцы отечественных ЛС при выборочном контроле направляются с архивным образцом фармацевтической субстанции, в количестве, достаточном для проведения двух анализов.
Образцы субстанций сопровождаются документами, подтверждающими качество субстанции, производителя субстанции и производителя ЛС по результатам входного контроля.
Слайд 44
Посерийный выборочный государственный контроль ЛС
проводится при возникновении
сомнений и споров о качестве ЛС между
производителем (поставщиком) и покупателем, при этом проверяются вызывающие сомнение ЛС и архивные образцы предприятия-производителя.
В СЛУЧАЕ ВОЗНИКНОВЕНИЯ СПОРОВ – АРБИТРАЖНЫЙ.
Слайд 45
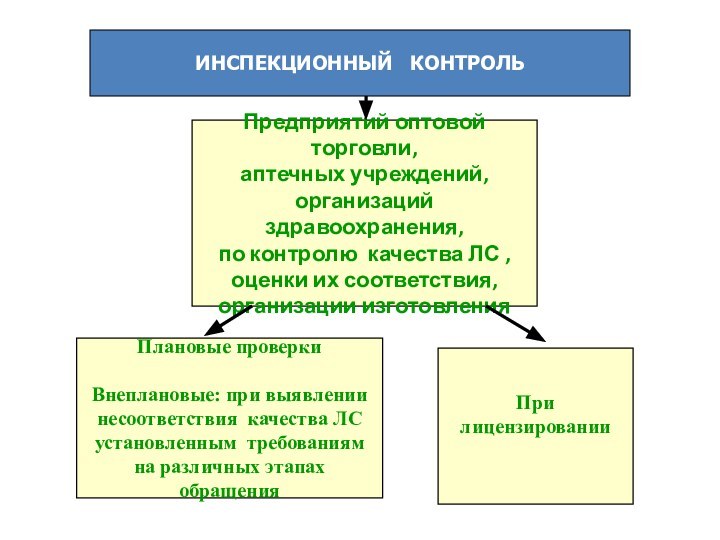
ИНСПЕКЦИОННЫЙ КОНТРОЛЬ
Предприятий оптовой торговли,
аптечных учреждений,
организаций здравоохранения,
по контролю
качества ЛС ,
оценки их соответствия,
организации изготовления
Плановые проверки
Внеплановые: при выявлении
несоответствия качества ЛС
установленным требованиям
на различных этапах обращения
При
лицензировании