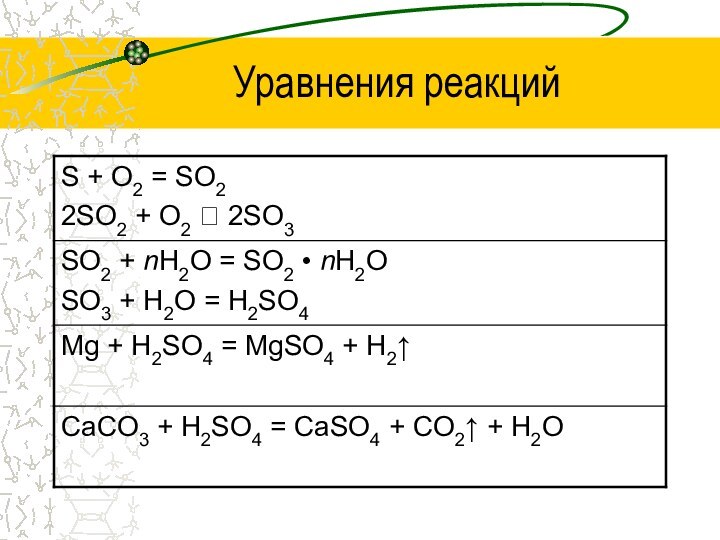
угля, нефти, при работе автомобилей. Диоксид серы также выделяется
при извержениях вулканов.Растворяясь в атмосферной влаге, они становятся причиной «кислотных дождей», которые поражают растительность, губят живые организмы водоемов, вызывают у людей болезни, разрушают металлоконструкции и строительные материалы.
Поэтому очень важно понимать причину кислотных дождей и научиться предотвращать их появление.