- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Окислительно-восстановительные реакции
Содержание
- 2. Цель урока: Закрепление, обобщение и углубление знаний об окислительно-восстановительных реакциях, расстановка коэффициентов методом электронного баланса
- 3. Опорные понятияПроцесс восстановления – процесс принятия электронов
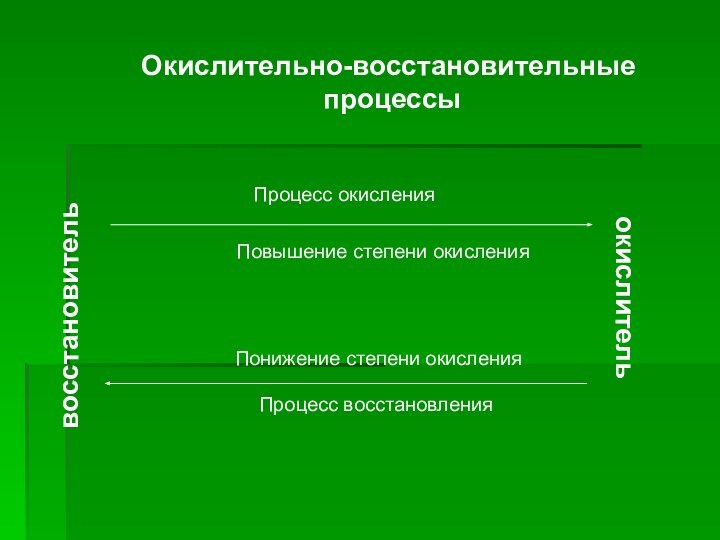
- 4. восстановительокислительПроцесс окисленияПовышение степени окисленияПонижение степени окисленияПроцесс восстановленияОкислительно-восстановительные процессы
- 5. Правила определения функции соединения в окислительно-восстановительных
- 6. Задание. Предскажите функции веществ в окислительно-восстановительных
- 7. Важнейшие окислители1. Простые вещества-неметаллы с наибольшими значениями
- 8. Важнейшие восстановители1. Все простые вещества-металлы. Наиболее активными
- 9. Задания В каких из указанных ниже веществ
- 10. Окислительно-восстановительные реакции (ОВР) – химические реакции, при протекании которых степени окисления элементов изменяются.Типы окислительно-восстановительных реакций
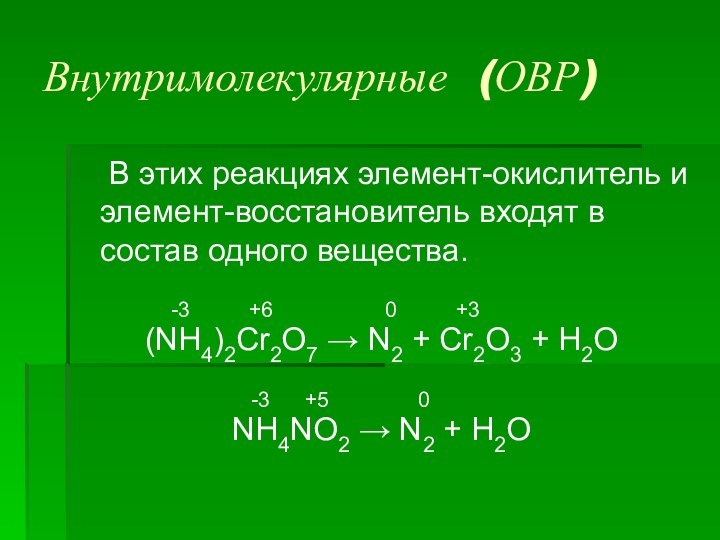
- 11. Межмолекулярные (ОВР) В этих реакциях элемент-окислитель и элемент-восстановитель
- 12. Внутримолекулярные (ОВР) В этих реакциях элемент-окислитель и элемент-восстановитель
- 13. Самоокисления- самовосстановления (диспропорционирования) (ОВР) Это ОВР, при протекании
- 14. Составление ОВР методом электронного баланса В основе
- 15. Алгоритм 1. Определим степени окисления всех элементов
- 16. 3. Составим уравнения процессов окисления и восстановления: +7
- 17. 5. Найденные множители запишем как коэффициенты перед
- 18. Выполните задания1. В каких из приведенных уравнений
- 19. 2. Определите типы окислительно-восстановительных реакций, расставьте коэффициенты
- 20. Скачать презентацию
- 21. Похожие презентации
Цель урока: Закрепление, обобщение и углубление знаний об окислительно-восстановительных реакциях, расстановка коэффициентов методом электронного баланса


















Слайд 2
Цель урока:
Закрепление, обобщение и углубление знаний об окислительно-восстановительных
реакциях, расстановка коэффициентов методом электронного баланса
Слайд 3
Опорные понятия
Процесс восстановления – процесс принятия электронов частицей
(атомом, молекулой, ионом). При восстановлении степень окисления элемента понижается.
Процесс
окисления – процесс отдачи электронов данной частицей (атомом, молекулой, ионом). При окислении степень окисления элемента повышается.Восстановители – частицы (атомы, молекулы или ионы), отдающие электроны.
Восстановители – доноры электронов (от лат. donare – дарить).
Окислители – частицы (атомы, молекулы или ионы), принимающие электроны.
Окислители – акцепторы электронов (от лат. аcceptor – получатель).
Слайд 4
восстановитель
окислитель
Процесс окисления
Повышение степени окисления
Понижение степени окисления
Процесс восстановления
Окислительно-восстановительные
процессы
Слайд 5
Правила
определения функции соединения в окислительно-восстановительных реакциях
1. Если
элемент проявляет в соединении высшую степень окисления, то это
соединение может быть окислителем.2. Если элемент проявляет в соединении низшую степень окисления, то это соединение может быть восстановителем.
3. Если элемент проявляет в соединении промежуточную степень окисления, то это соединение может быть как окислителем, так и восстановителем.
Слайд 6 Задание. Предскажите функции веществ в окислительно-восстановительных реакциях: H2SO4(конц),
SO2, S, H2S
Ответ
H2SO4(конц) – окислитель, так как элемент
сера проявляет в данном соединении высшую степень окисления (+6).H2S – восстановитель, так как элемент сера проявляет в данном соединении низшую степень окисления (-2).
SO2, S – окислитель или восстановитель ( в зависимости от сореагентов), так как элемент сера проявляет в данных соединениях промежуточную степень окисления.
Нами предсказаны функции веществ по сере. Если же рассматривать оба элемента, входящие в состав вещества, например, в случае H2S, то наряду с восстановительными свойствами соединение обладает и окислительными свойствами по элементу водороду, имеющему степень окисления +1.
H2S + Zn = ZnS + H2
Слайд 7
Важнейшие окислители
1. Простые вещества-неметаллы с наибольшими значениями электроотрицательности
– F2, O2;
2. Сложные вещества, молекулы которых содержат элементы
в высшей степени окисления – KMnO4, K2Cr2O7, HNO3, нитраты, H2SO4(конц), PbO2, HClO4, перхлораты3. Среди веществ, содержащих элементы в промежуточных степенях окисления, более характерны окислительные свойства для Cl2, Br2, HClO, KClO3, MnO2, соли трехвалентного железа (FeCl3).
Слайд 8
Важнейшие восстановители
1. Все простые вещества-металлы. Наиболее активными восстановителями
являются щелочные и щелочно-земельные металлы, Mg, Al, Zn.
2. Сложные
вещества, молекулы которых одержат элементы в низшей степени окисления – CH4, SiH4, NH3, PH3, нитриды и фосфиды металлов (например NaN3, Ca3P2), H2S, сульфиды металлов, HI, HBr, HCl, галогениды металлов, гидриды металлов (например, NaH, CaH2.3. Среди веществ, содержащих элементы в промежуточных степенях окисления, более характерны восстановительные свойства для С, СО, сульфитов металлов (Na2SO3), соли двухвалентного железа (FeSO4).
Слайд 9
Задания
В каких из указанных ниже веществ марганец
может проявлять только восстановительные свойства или только окислительные, или
те и другие: KMnO4, MnO2, Mn2O7, Mn0, K2MnO4, MnO?В каких из перечисленных ниже веществ хром может проявлять только восстановительные свойства, только окислительные или те и другие: Сr2(SO4)3, CrO3, K2CrO4, Cr, CrCl2, K2Cr2O7?
Укажите, в каких из приведенных ниже веществ сера может проявлять только восстановительные свойства, только окислительные, те и другие: S, H2S, H2SO3, SO3, FeS, SO2, H2SO4, Na2S2O3.
Слайд 10 Окислительно-восстановительные реакции (ОВР) – химические реакции, при протекании
которых степени окисления элементов изменяются.
Типы
окислительно-восстановительных реакций
Слайд 11
Межмолекулярные (ОВР)
В этих реакциях элемент-окислитель и элемент-восстановитель входят
в состав молекул различных веществ
0 0 -3 +1N2 + H2 → NH3
+3 -1 +2 0
FeCl3 + KI → FeCl2 + I2 + KCl
Слайд 12
Внутримолекулярные (ОВР)
В этих реакциях элемент-окислитель и элемент-восстановитель входят
в состав одного вещества.
-3 +6 0 +3(NH4)2Cr2O7 → N2 + Cr2O3 + H2O
-3 +5 0
NH4NO2 → N2 + H2O
Слайд 13
Самоокисления- самовосстановления (диспропорционирования) (ОВР)
Это ОВР, при протекании которых
один и тот же элемент, находится в промежуточной степени
окисления, и окисляется и восстанавливается. Часть атомов данного элемента отдает электроны другой части атомов этого же элемента.+4 +3 +5
NO2 + H2O → HNO2 + HNO3
0 -1 +1
Cl2 + Ca(OH)2 → CaCl2 + Ca(ClO)2 + H2O
Слайд 14
Составление ОВР методом электронного баланса
В основе данного
метода лежит следующее правило: общее число электронов, которое отдает
восстановитель, должно быть равно общему числу электронов, которое присоединяет окислитель.Рассмотрим применение метода электронного баланса на примере реакции, которая выражается следующей схемой:
KMnO4 + KBr + H2SO4 → MnSO4 + Br2 + K2SO4 + H2O
Слайд 15
Алгоритм
1. Определим степени окисления всех элементов в
молекулах исходных веществ и продуктов реакции:
+1 +7 -2 +1 -1 +1+6 -2 +2 +6 -2 0 +1+6 -2 +1-2KMnO4 + KBr + H2SO4 → MnSO4 + Br2 + K2SO4 + H2O
2. Подчеркнем символы элементов, которые изменяют степени окисления в ход реакции:
+7 -1 +2 0
KMnO4 + KBr + H2SO4 → MnSO4 + Br2 + K2SO4 + H2O
Слайд 16
3. Составим уравнения процессов окисления и восстановления:
+7
+2
Mn + 5ē → Mn (восстановление)
-1 0
2Br - 2ē → Br2 (окисление)
4. Находим множители для уравнений процессов окисления и восстановления, при умножении на которые числа отданных и присоединенных электронов будут равны. Так как наименьшим общим кратным чисел «5» и «2» является «10», то уравнение процесса восстановления нужно умножить на «2», а уравнение процесса окисления - на «5»
+7 +2
Mn + 5ē → Mn ן2
-1 0
2Br - 2ē → Br2 ן5
Слайд 17 5. Найденные множители запишем как коэффициенты перед формулами
веществ, которые содержат элементы, участвующие в процессах окисления и
восстановления:2KMnO4 + 10KBr + H2SO4 → 2MnSO4 + 5Br2 + K2SO4 + H2O
6. После этого уравняем числа атомов элементов, которые не изменяют степени окисления. В данном случае это атомы калия, серы, водорода и кислорода.
2KMnO4 + 10KBr + 8H2SO4 → 2MnSO4 + 5Br2 + 6K2SO4 + 8H2O
Обычно числа атомов водорода и кислорода уравнивают в последнюю очередь. Во многих случаях равенство чисел атомов кислорода в левой и правой частях уравнения ОВР свидетельствует о том, что это уравнение составлено правильно.
Слайд 18
Выполните задания
1. В каких из приведенных уравнений реакций
соединения железа является окислителями, в каких восстановителями, расставьте коэффициенты
методом электронного баланса:A) Fe2О3 + Al = Fe + Al2O3
B) Fe2О3 + KNO3 + KOH = K2FeO4 + KNO2 + H2O
C) FeSO4 + Mg = MgSO4 + Fe
D) FeSO4 + KMnO4 + H2SO4 = Fe2(SO4)3 + MnSO4 + K2SO4 + H2O
E) Fe(OH)2 + O2 + H2O = Fe(OH)3
Слайд 19 2. Определите типы окислительно-восстановительных реакций, расставьте коэффициенты методом
электронного баланса:
H2S + HNO3 = H2SO4 + NO2 +
H2OH2S + H2SO3 = S + H2О
Pb(NO3)2 = PbO + NO2 + O2
NaNO3 = NaNO2 + O2
NH4NO2 = N2 + H2О
HNO2 = HNO3 + NO + H2O
3. В схемах реакций растворения металлов в азотной кислоте подберите коэффициенты методом электронного баланса:
Ag + HNO3 → AgNO3 + NO2 + H2O
Cu + HNO3 → Cu(NO3)2 +NO +H2O
Ca + HNO3 → Ca(NO3)2 + N2O + H2O
Mg + HNO3 → Mg(NO3)2 + N2 + H2O
Mg + HNO3 → Mg(NO3)2 + NH4NO3 + H2O
Fe + HNO3 → Fe(NO 3)3 + NO2 +H2O