- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Оксиды (11 класс)
Содержание
- 2. Оксиды - этосложные вещества,состоящие из двух элементов,
- 3. Способы получения оксидов.Взаимодействие простых веществ с кислородом:
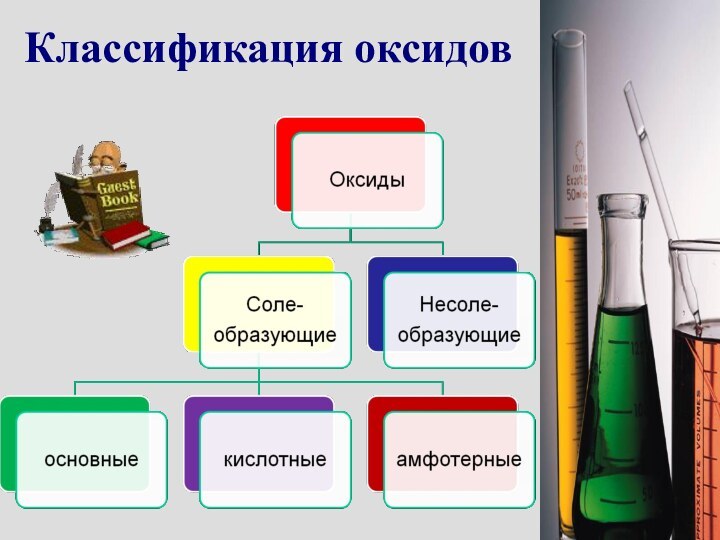
- 4. Классификация оксидов
- 5. НесолеобразующиеоксидыЭто оксиды, которые не взаимодействуют ни с
- 6. Основные оксидыЭто оксиды, которым в качестве гидроксидов
- 7. Химические свойстваосновных оксидов.Взаимодействие с кислотами, с образованием
- 8. Кислотные оксидыЭто оксиды, которым в качестве гидроксидов
- 9. Химические свойствакислотных оксидов.С основаниями, образуя соль и
- 10. АМФОТЕРНЫЕ ОКСИДЫ. Это оксиды, которым соответствуют гидроксиды,
- 11. Химические свойстваамфотерных оксидов. В качестве основных оксидов.
- 12. Вывод. С повышением степени окисления атомов элемента,
- 13. Скачать презентацию
- 14. Похожие презентации
Оксиды - этосложные вещества,состоящие из двух элементов, один из которых кислород.Например: CaO, SO2, Al2O3, CO.












Слайд 3
Способы получения оксидов.
Взаимодействие простых веществ с кислородом:
2Mg
+ O2 = 2Mg O2. Горение на воздухе сложных веществ:
CH4 + 2O2 = CO2 + 2H2O
3. Разложение нерастворимых оснований:
Mg(OH)2 = MgO + H2O
4. Разложение некоторых кислот:
H2SiO3 = SiO2 + H2O
5. Разложение некоторых солей:
CaCO3 = CaO + CO2
Слайд 5
Несолеобразующие
оксиды
Это оксиды, которые не взаимодействуют ни с кислотами,
ни с основаниями и не образуют солей. Оксиды образованы
атомами неметаллов:CO, NO, N2O, SiO.
Солеобразующие
оксиды
Это оксиды, которые взаимодействуют с кислотами или со щелочами с образованием солей и воды: N2O5, CO2, CaO, Na2O.
Слайд 6
Основные оксиды
Это оксиды, которым в качестве гидроксидов
соответствуют
основания.
Например: CuO → Cu(OH)2
Основные оксиды образуют только металлы
со степенью окисления +1, +2.
Например: Na2O, K2O, CaO, MgO, CuO, CrO.
Исключение BeO, ZnO, SnO, PbO.
Слайд 7
Химические свойства
основных оксидов.
Взаимодействие с кислотами, с образованием соли
и воды:
MgO + HCl =
MgCl2 + H2O 2. С кислотными оксидами, образуя соли:
CaO + N2O5 = Ca(NO3)2
3. С водой (реагируют только оксиды щелочных и щелочно-земельных металлов):
Na2O + H2O = 2NaOH
Слайд 8
Кислотные оксиды
Это оксиды, которым в качестве гидроксидов соответствуют
кислоты.
Например: SO3 → H2SO4
Кислотные оксиды
образуют все неметаллы в любой степени окисления, исключая несолеобразующие оксиды, и металлы со степенью окисления +5 и выше. Например: CO2, N2O5, SiO2,
Mn2O7, CrO3.
Слайд 9
Химические свойства
кислотных оксидов.
С основаниями, образуя соль и воду:
CO2 + 2KOH = K2CO3
+ H2O2. С основными оксидами, образуя соли:
CO2 + MgO = MgCO3
3. С водой (большинство оксидов), образуя кислоты:
SO3 + H2O = H2SO4
CrO3 + H2O = H2CrO4
Слайд 10
АМФОТЕРНЫЕ
ОКСИДЫ.
Это оксиды, которым соответствуют гидроксиды, проявляющие
свойства как оснований, так и кислот.
Например:
BeO
→ Be(OH)2 → H2BeO2ZnO → Zn(OH)2 → H2ZnO2
Амфотерные оксиды образуют только металлы со степенью окисления +3, +4.
Например: Cr2O3, Fe2O3, Al2O3.
Оксиды BeO, ZnO , SnO, PbO также являются амфотерными.
Слайд 11
Химические свойства
амфотерных оксидов.
В качестве основных оксидов.
С
кислотами, образуя соль и воду:
ZnO + 2HCl = ZnCl2 + H2O 2. С кислотными оксидами, образуя соли:
ZnO + SiO2 = ZnSiO3
В качестве кислотных оксидов.
Со щелочами, образуя соль и воду:
ZnO + 2KOH = K2ZnO2 + H2O
2. С основными оксидами, образуя соли:
ZnO + CaO = CaZnO2
С водой амфотерные оксиды не взаимодействуют.
Слайд 12
Вывод.
С повышением степени окисления атомов элемента, образующего
оксиды, увеличиваются кислотные свойства его оксидов и гидроксидов.
Неметаллы образуют кислотные оксиды ( исключение - несолеобразующие оксиды).Металлы





























