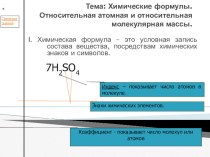
характеристику простій речовині кисню за планом:
знаходження в природі;фізичні властивості
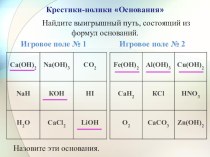
хімічні властивості;
добування;
застосування
Сформувати поняття про оксиди, окиснення, горіння;
З’ясувати умови виникнення та припинення горіння;
ознайомитись з заходами протипожежної безпеки.
Учитель хімії Верхівцевського Н В К Кукса Н.М.