- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Фосфор как простое вещество
Содержание
- 2. Фосфор как простое вещество
- 3. История открытия и изучения фосфора Хенниг Брандв
- 4. История открытия и изучения фосфора Г. Лейбниц
- 5. История открытия и изучения фосфора Ж. Пруст
- 6. История открытия и изучения фосфора А.А.Мусин-Пушкин в
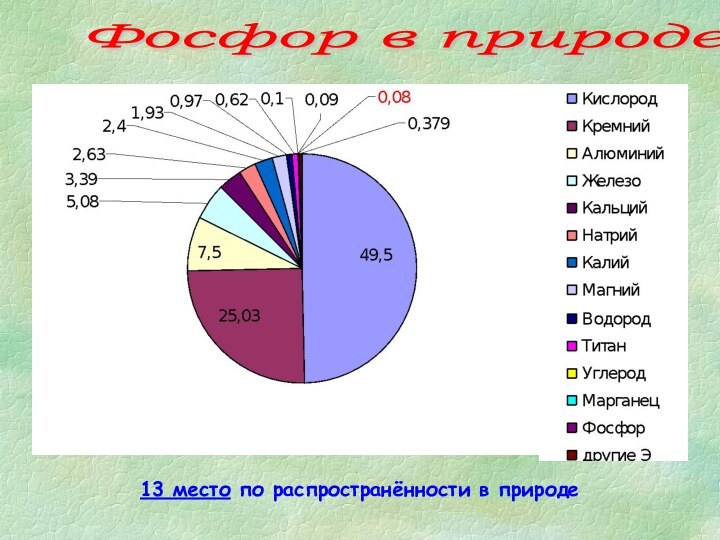
- 7. Фосфор в природе 13 место по распространённости в природе
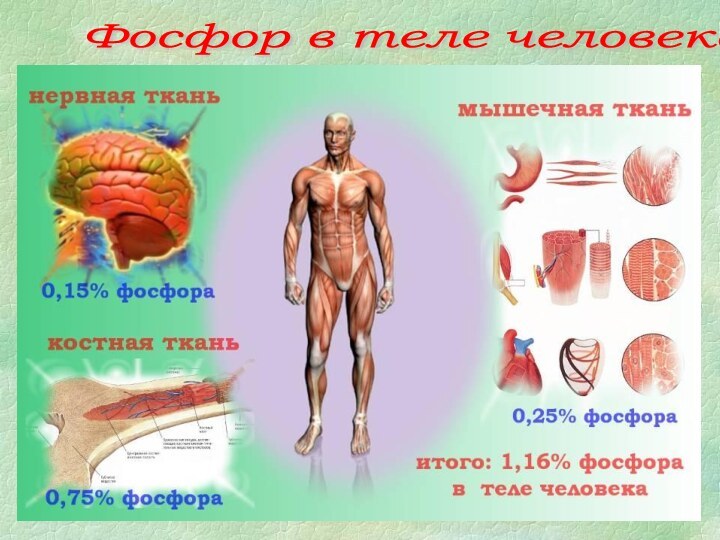
- 8. Фосфор в теле человека
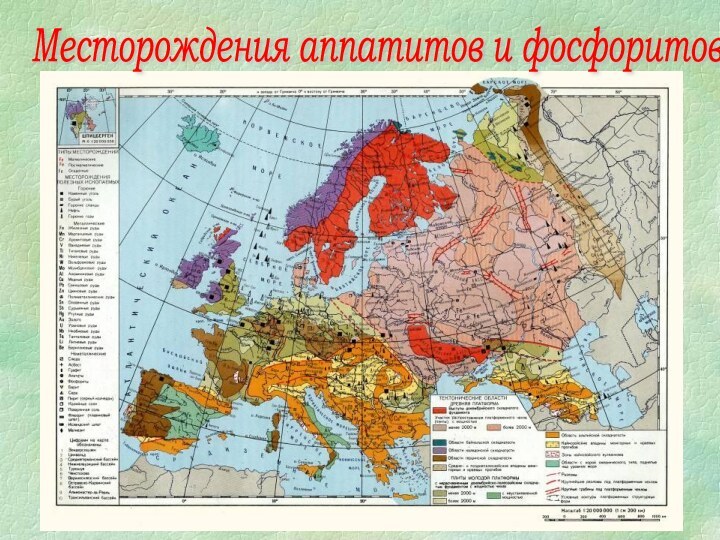
- 9. Минералы фосфора
- 10. Месторождения аппатитов и фосфоритов в РФ
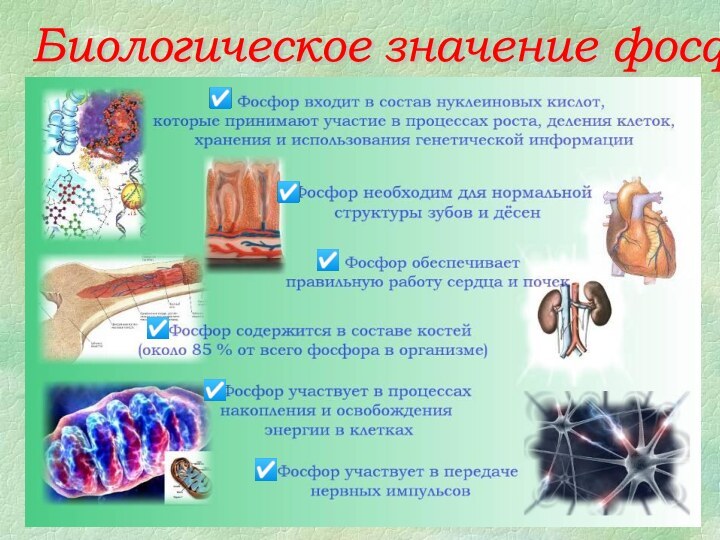
- 11. Биологическое значение фосфора ☑☑☑☑☑☑
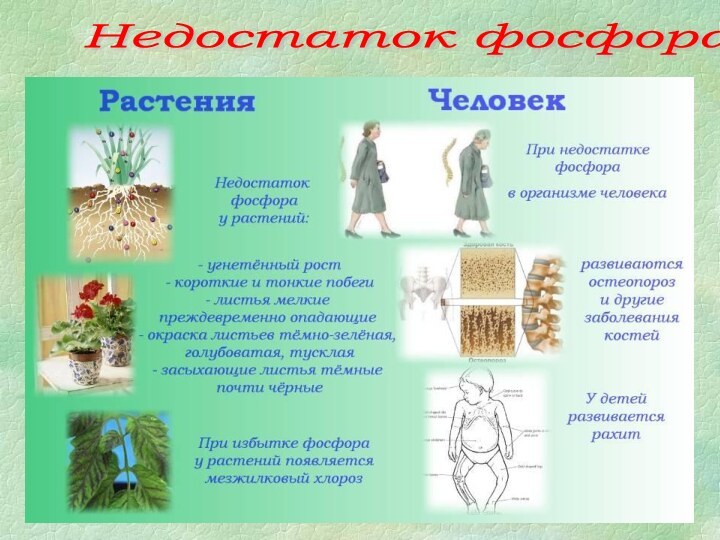
- 12. Недостаток фосфора
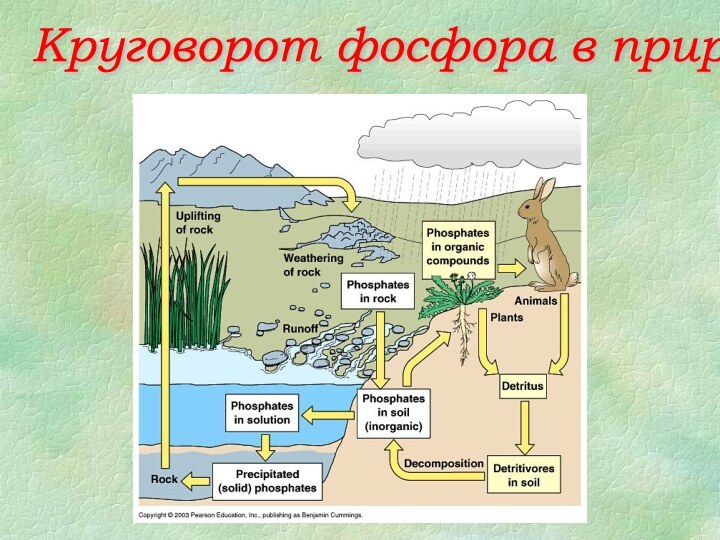
- 13. Круговорот фосфора в природе
- 14. Аллотропные модификации фосфора 560 °C500 °CВ атм.
- 15. Химические свойства фосфора ?????????Какие свойства, окислительные или восстановительные, проявляет фосфор в химических реакциях? ?
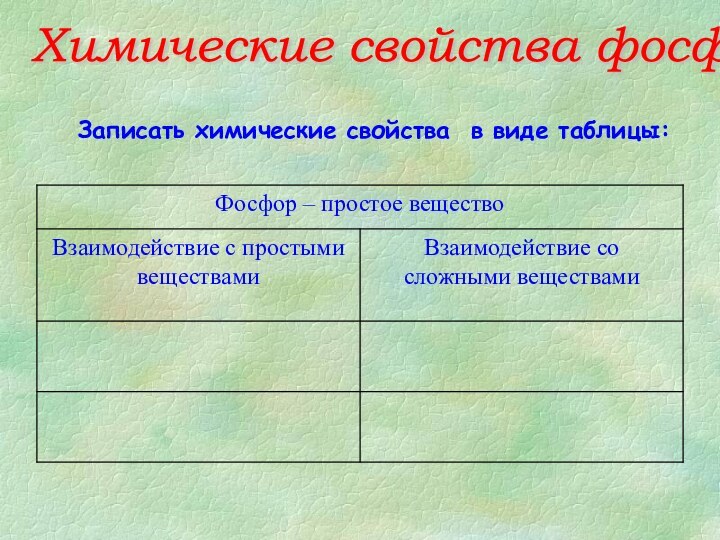
- 16. Химические свойства фосфора Записать химические свойства в виде таблицы:
- 17. Взаимодействие с простыми веществами Взаимодействие с кислородом4P
- 18. Взаимодействие с простыми веществами Взаимодействие с другими
- 19. РН3- ядовитый газ с неприятным запахом. Легко
- 20. Взаимодействие с простыми веществами 2P (красн.) +
- 21. P4 + 3NaOH + 3H2O = PH3
- 22. Взаимодействие со сложными веществами Взаимодействие с конц.
- 23. Взаимодействие с бертолетовой солью.
- 24. Химические свойства фосфора Р -3
- 25. Получение фосфора Фосфор получают из апатитов или
- 26. Скачать презентацию
- 27. Похожие презентации


















Слайд 4
История открытия и изучения фосфора
Г. Лейбниц
Купил
секрет
получения фосфора
Р. Бойeль.
В 1680 г.
получил фосфор
Независимо от Бранда
Слайд 5
История открытия и изучения фосфора
Ж. Пруст и
М. Клапрот
в 1788 г.
доказали чрезвычайно большую
распространенность
в природе минералов, содержащих фосфат кальция.
Антуан Лоран Лавуазье
В начале 70-х годов XVIII в
доказал, что фосфор - простое тело.
Слайд 6
История открытия и изучения фосфора
А.А.Мусин-Пушкин
в 1797
г.
Получил фиолетовый (красный) фосфор
И. Гитторф
в 1853 г
Получил
фиолетовый (красный) фосфор
Слайд 14
Аллотропные модификации фосфора
560 °C
500 °C
В атм. СО
10
8,3·10 Па
t без
доступа воздухаP4
(P4)n
(P)n
(P)n
t пл. = 44,1 °С
Ρ = 1823 кг/м³
Светится при
комнатной
температуре
t пл. = 240 °С
Ρ = 2400 кг/м³
Не светится
Растворяется только
в трибромиде фосфора
t пл. = 1000 °С
Ρ = 2690 кг/м³
Не светится
Не растворяется
Проводит эл. ток
Ρ = 3830 кг/м³
Не светится
Проводит эл.ток
Слайд 15
Химические свойства фосфора
?
?
?
?
?
?
?
?
?
Какие свойства, окислительные или восстановительные,
проявляет фосфор в химических реакциях?
?
Слайд 17
Взаимодействие с простыми веществами
Взаимодействие с кислородом
4P +
5O2 = 2P2O5
(с избытком кислорода)
4P + 3O2 = 2P2O3
(при медленном окислении или при недостатке О2).
Белый фосфор горит даже под водой.
Слайд 18
Взаимодействие с простыми веществами
Взаимодействие с другими неметаллами
2P + 3Cl2 = 2PCl3 2P
+ 3S = P2S3, Слайд 19 РН3- ядовитый газ с неприятным запахом. Легко воспламеняется
на воздухе. Это свойство фосфина и объясняет появление болотных
блуждающих огней.Взаимодействие с простыми веществами
(t=300-360 °C),
2P + 3H2 = 2PH3,
фосфин
Слайд 20
Взаимодействие с простыми веществами
2P (красн.) +
3Mg = +2Mg3P2
фосфид магния 2P (красн.) + 3Ca = +2Ca3P2
фосфид кальция
Слайд 21 P4 + 3NaOH + 3H2O = PH3 +
3NaH2PO2
Взаимодействие со щелочами. При нагревании белого
фосфора в растворе щелочи он диспропорционирует:
Взаимодействие со сложными веществами
Слайд 22
Взаимодействие со сложными веществами
Взаимодействие с конц.
азотной кислотой: 3Р + 5HNO3 + 2H2O = 3H3PO4
+ 5NOСлайд 23 Взаимодействие с бертолетовой солью. Реакция
протекающая при зажигании спички
Взаимодействие со сложными веществами
P +
5KClO3 = 5KCl + 3P2O5
Слайд 25
Получение фосфора
Фосфор получают из апатитов или фосфоритов
в результате взаимодействия с коксом и кремнезёмом при температуре
1600 °С:2Ca3(PO4)2+10C+6SiO2→P4+10CO+6CaSiO3.
Образующиеся пары белого фосфора конденсируются в приёмнике под водой. Вместо фосфоритов восстановлению можно подвергнуть и другие соединения, например, метафосфорную кислоту:
4HPO3 + 12C → 4P + 2H2 + 12CO.
Белый фосфор получают из красного в атмосфере СО2
Печь для получения фосфора в промышленности





























