Слайд 2
Почему геохимик А.Е.Ферсман назвал серу «двигателем химической промышленности»?
Слайд 3
Цели урока:
Рассмотреть свойства важнейших соединений серы – сероводорода
и её солей, оксидов серы, сероводородной и сернистой кислот
Освоить
навык определения ионов S2- и сульфит-ионов SО32-
Развить способность эффективно использовать знаковые системы, наблюдения, сравнения, делать выводы
Слайд 4
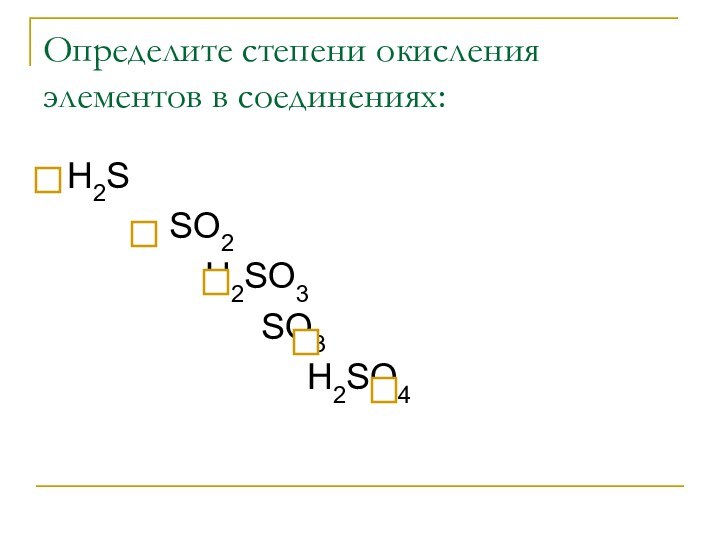
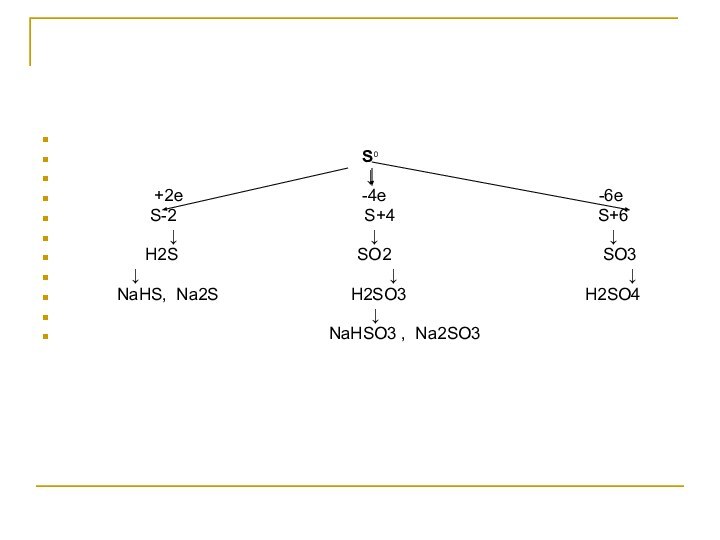
Определите степени окисления элементов в соединениях:
Н2S
Слайд 5
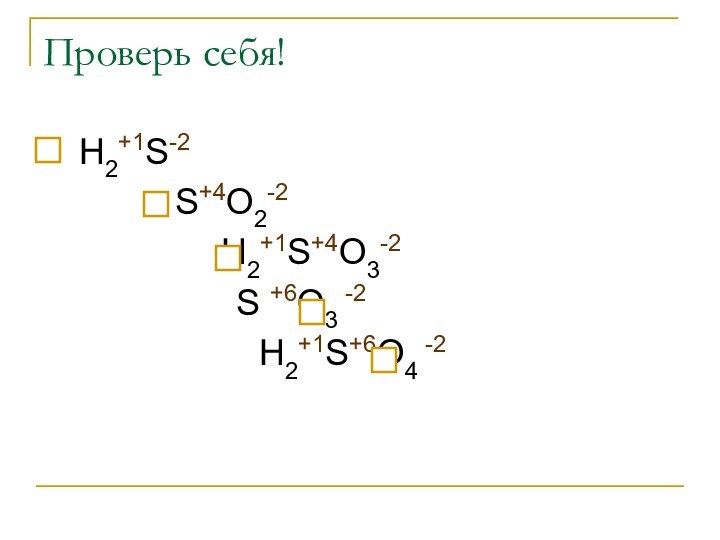
Проверь себя!
Н2+1S-2
S+4O2-2
Н2+1S+4O3-2
S +6O3 -2
Н2+1S+6O4
-2
Слайд 6
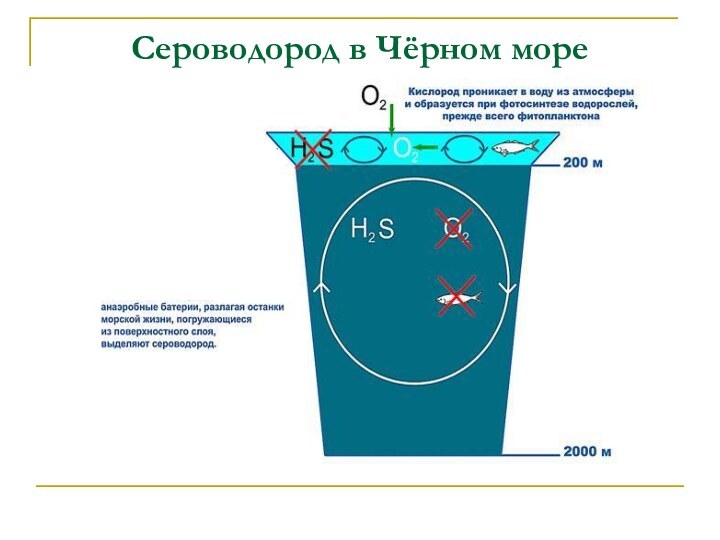
Сероводород Н2S-2(низшая степень окисления)
Физические свойства:
Бесцветный газ
с запахом тухлых яиц, ядовит.
Предельно допустимая концентрация в воздухе
10мг/м3
Водный раствор – сероводородная кислота
Слайд 7
Пятигорск – природный музей минеральных вод
Cероводородные источники.
Классификация минеральных
вод Пятигорска:
углекисло-сероводородные сложного ионно-солевого состава,
радоновые воды, углекислые
воды (горячие, теплые, холодные),
минеральные воды ессентукского типа
(углекислые и углекисло-сероводородные)
Слайд 9
Н2S-2 - сероводород
Химические свойства:
1.Реакция взаимодействия с кислородом
(определите степени
окисления элементов,
расставьте коэффициенты в уравнениях реакций,
определите свойства
Н2S c позиции окислительно-восстановительных процессов)
Вариант -1.
Н2S + O2 → S↓ + Н2O
недостаток
Вариант -2.
Н2S + O2 → SО2+ Н2O
избыток
Слайд 10
Проверь себя!
Н2S-2 – восстановитель
Вариант -1.
2Н2S-2 + O20 =
2S0↓ + 2Н2O-2
Вариант -2.
2Н2S-2 + 3O20= 2S+4О2+ 2Н2O-2
Слайд 11
Н2S -2 - восстановитель
2. Реакция взаимодействия с растворами
галогенов:
2Н2S-2 +I20 = 2S0↓ + 2Н+1I-1
йод
Слайд 12
Н2S – сероводородная кислота
Неустойчивая, на свету мутнеет.
Почему?
2,5V Н2S : 1V Н2О
Н2S↔Н++ НS- гидросульфид-ион
НS- ↔
Н++ S2- сульфид- ион
Слайд 13
Cоли: гидросульфиды и сульфиды
В природе – 200 минералов-сульфидов
Сульфиды
свинца (галенит или свинцовый блеск РbS),
ртути (киноварь HgS),
железа (пирит или железный колчедан FeS2)
цинка ( cфалерит ZnS)
Слайд 14
Качественная реакция на сульфид-ион S2-
В пробирку с
раствором соли сульфида натрия Na2S прилейте 1-2 мл раствора
соли хлорида меди(II) СuCl2.
Что наблюдаете?
Рассмотрите реакцию с точки зрения ТЭД, запишите уравнение реакции в трех видах.
Слайд 15
Качественная реакция на сульфид-ион S2-
Na2S + СuCl2 =2NaCl
+ СuS↓(черный осадок)
2Na+ +S2- +Cu2+ + 2Cl- =2Na++ 2Cl-
+ СuS↓
Cu2+ + S2- = СuS↓
Слайд 16
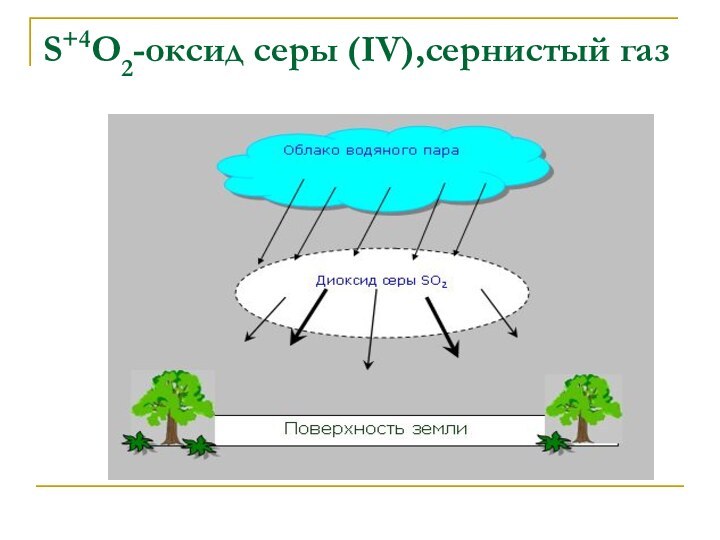
S+4O2-оксид серы (IV),сернистый газ(промежуточная степень окисления)
Слайд 17
«Последний день Помпеи»
К. П. Брюллов
Слайд 18
S+4O2-оксид серы (IV),сернистый газ(промежуточная степень окисления)
Физические свойства:
бесцветный газ с резким запахом, ядовит.
Предельно допустимая
концентрация в воздухе 0,06мг/л
Получение.
S0 +O2 = S+4O2 ↑
Слайд 19
Химические свойства:
S+4O2
1.Реакция взаимодействия с кислородом (получение SO3)
2S+4O2
+ O20= 2S+6O3(кислотный, бесцветная жидкость)
2. Реакция взаимодействия с углеродом
S+4O2 +С0 =S0 +СO2
Слайд 20
S+4O2-оксид серы (IV),сернистый газ
Слайд 21
H2S+4О3- сернистая кислота
Существует только в растворе, непрочное соединение
40V
SО2 :1 V Н2О
SО2 +Н2О ↔Н2 SО3
Н2 SО3
↔Н+ + НSО3- гидросульфит - ион
НSО3- ↔ Н+ + SО32- сульфит – ион
Слайд 22
Качественная реакция на сульфит-ион SО32-
Na2SО3 +2НСl= 2NaСl
+ Н2SО3
2Na+ + SО32- +2Н+ +2Сl- =2Na+ +2Сl- +
Н2О+ SО2
2Н+ + SО32-= Н2О+ SО2
Слайд 23
S+6O3 – оксид серы (VI), кислотный оксид (высшая
степень окисления серы)
S+6O3- бесцветная жидкость
S+6O3 + Н2О =Н2 S+6O4
серная кислота
Слайд 24
Как изменяются свойства веществ в зависимости от степени
окисления?
Почему геохимик А.Е.Ферсман назвал серу «двигателем химической промышленности»?
Итоги урока
7-8
баллов- оценка 5
5-6 баллов - оценка 4